
����Ŀ�������к���C��N��Mn��Ԫ�أ�ʵ���г��ù��������������ⶨ�������̵ĺ�������Ӧԭ��Ϊ2Mn2++5S2O82-+8H2O![]() 2MnO4-+10SO42-+16H+
2MnO4-+10SO42-+16H+
��1��Mnԭ�ӵļ۲���ӵĹ���Դ�ʽ�������Ų�ͼ��Ϊ______��
��2����֪H2S2O8�Ľṹ��ʽ��ͼ��ʾ��
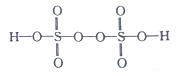
��H2S2O8��S�Ĺ���ӻ���ʽΪ______��H��O��S����Ԫ���У��縺������Ԫ����_________����Ԫ�ط��ţ���
��S��̬ԭ���е��ӵ��˶�״̬��_________�֡�
��������Ӧ��S2O82-���ѵĹ��ۼ�����Ϊ________������Ҽ����м���) ��ÿ����1molMnO4-,���ѵĹ��ۼ���ĿΪ_________NA��
��3��C��N���γɶ��ֽṹ�ľ��塣һ�����͵ij�Ӳ���������ڽ��ʯ�Ľṹ����Ӳ�ȱȽ��ʯ���侧����ͼ��ʾ��ͼʾԭ�Ӷ������ھ����ڣ����仯ѧʽΪ________����֪��������a=0.64nm, b=0.55nm��c=0.24nm����þ�����ܶ�Ϊ________���г�ʽ�Ӽ��ɣ���ʽ���в�������ĸ��g/cm3��
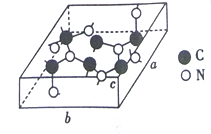
���𰸡� ![]() sp3 O 16 �Ҽ� 2.5 C3N4
sp3 O 16 �Ҽ� 2.5 C3N4 ![]()
����������1��Mnԭ�ӵļ۲���ӵĹ������ʽ�������Ų�ͼ��Ϊ![]() ����2����H2S2O8��S��4��Oԭ���γ�4������������ӻ���ʽΪsp3��ͬ�������϶��µ�һ�����ܼ�С��H��O��S����Ԫ���У��縺������Ԫ����O����SԪ��Ϊ16��Ԫ�أ�ԭ�Ӻ�����16�����ӣ�ÿ�����ӵ��˶�״̬����ͬ������16�ֲ�ͬ�ĵ�������������Ӧ��S2O82-���ѵĹ��ۼ�����Ϊ������������ ��2Mn2++5S2O82-+8H2O
����2����H2S2O8��S��4��Oԭ���γ�4������������ӻ���ʽΪsp3��ͬ�������϶��µ�һ�����ܼ�С��H��O��S����Ԫ���У��縺������Ԫ����O����SԪ��Ϊ16��Ԫ�أ�ԭ�Ӻ�����16�����ӣ�ÿ�����ӵ��˶�״̬����ͬ������16�ֲ�ͬ�ĵ�������������Ӧ��S2O82-���ѵĹ��ۼ�����Ϊ������������ ��2Mn2++5S2O82-+8H2O![]() 2MnO4-+10SO42-+16H+��ÿ����2molMnO4-,����5mol���ۼ�����ÿ����1molMnO4-,���ѵĹ��ۼ���ĿΪ2.5NA����3����������6��C��8��N���ʻ�ѧʽΪC3N4����=m/V=
2MnO4-+10SO42-+16H+��ÿ����2molMnO4-,����5mol���ۼ�����ÿ����1molMnO4-,���ѵĹ��ۼ���ĿΪ2.5NA����3����������6��C��8��N���ʻ�ѧʽΪC3N4����=m/V=![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.ij��ɫ����Һ�п��ܴ�������Ag+��Mg2+��Cu2+�еļ������ӡ�
��1�������κ�ʵ��Ϳ��Կ϶�ԭ��Һ�в����ڵ�������________��
��2��ȡ����ԭ��Һ�������ϡ���ᣬ�а�ɫ�������ɣ��ټ������ϡ���ᣬ��ɫ��������ʧ��ԭ��Һ�п϶��е�������_______�����ӷ�Ӧ����ʽΪ____________________��
��3��ȡ��2������Һ�������NaOH�����ְ�ɫ������˵��ԭ��Һ�п϶����ڵ�������______________��
��4��ԭ��Һ�п��ܴ������ڵ�������������A��D�е����������________��
A��Cl- B��NO3- C��CO32- D��OH-
������1����CuCl2��Һ�еμ�NaOH��Һ������________�����ӷ���ʽ��______________��
��2����NaHCO3��Һ�еμ�ϡ���ᣬ����________�����ӷ���ʽ��______________________��
��3��ϡ�����KOH��Һ��ϣ�����________�����ӷ���ʽ��__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ�֧�֡����İ��ˡ���һ����Ҫ�����ǣ���������˶�Ա�����˷ܼ���ij���˷ܼ��Ľṹ��ʽ����ͼ��ʾ���йظ����ʵ�˵����ȷ���� �� ��

A. ��FeCl3��Һ����ɫ����Ϊ�������뱽������ͬϵ��
B. ����KMnO4(H+)��Һ���۲���ɫ��ȥ����֤���ṹ�д���̼̼˫��
C. 1 mol��������Ũ��ˮ��H2��Ӧ�������Br2��H2�ֱ�Ϊ4 mol��7 mol
D. �÷����е�����̼ԭ�Ӳ����ܹ�ƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ϩ��һ�ֻ���ԭ�ϣ�������ת����ϵ��

��֪��

�ش��������⣺
(1)A������(ϵͳ����)��_____��B��C�ķ�Ӧ������_________��
(2)B�Ľṹ��ʽ��____��D�ĺ˴Ź���������________��塣
(3)���������л�Ϊͬϵ�����________________(��������)��
(4)F����PHB�Ļ�ѧ����ʽ��___________________
(5)E��ͬ���칹���У����ܷ���������Ӧ��Ҳ����̼��������Һ��Ӧ�Ĺ���________��(�����������칹)��
(6)F���˺ϳ�PHB�⣬���ɾ���_________���������ۺ�������Ӧ�ϳ�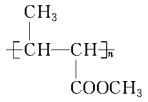 ��һ�������л����������ϣ����ڴ��������£���������Ӧ�Ļ�ѧ����ʽ��___________________��
��һ�������л����������ϣ����ڴ��������£���������Ӧ�Ļ�ѧ����ʽ��___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڼס��ҡ������������л����˵����ȷ����
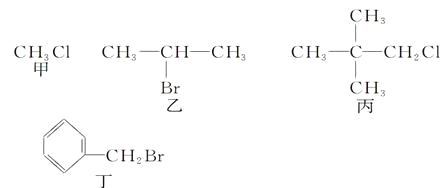
A. �ס��ҡ��������зֱ������ˮ�����к���ɫҺ������
B. �ס��ҡ��������м���NaOH��Һ���ȣ�Ȼ�����ϡ���������Һ�����ԣ��ٵ���AgNO3��Һ�����г�������
C. �ס��ҡ��������м���NaOH�Ĵ���Һ���ȣ�Ȼ�����ϡ���������Һ�����ԣ��ٵ���AgNO3��Һ�����г�������
D. �ҷ�����ȥ��Ӧ�õ�����ϩ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�ױ����Խ�������ת����

�ش��������⣺
��1����Ӧ���ķ�Ӧ����Ϊ__________����Ӧ���ķ�Ӧ����Ϊ_____________��
��2��������A�Ľṹ��ʽΪ____________��������D�ķ���ʽΪ_____________��
��3����Ӧ���Ļ�ѧ����ʽΪ_______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ�״���£���22.4L HCl��ȫ����1Lˮ�У�ˮ���ܶȽ���Ϊ1g/mL������Һ���ܶ�Ϊ�� g/cm3����>1������Һ�����ΪV mL�����ʵ���������Ϊw�����ʵ����ʵ���Ũ��Ϊc mol/L��������������ȷ���ǣ�������
��w=![]() ��100%�� ��c=1molL��1�� ����������Һ���ټ���V mLˮ��������Һ��������������0.5w�� ��������Һ�к���NA��HCl���ӣ�
��100%�� ��c=1molL��1�� ����������Һ���ټ���V mLˮ��������Һ��������������0.5w�� ��������Һ�к���NA��HCl���ӣ�
A. ȫ�� B. �٢ۢ� C. �٢� D. ֻ�Т�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й������뾶��˵����ȷ����(����)
A.���Ӳ����ٵ�Ԫ�ص�ԭ�Ӱ뾶һ��С�ڵ��Ӳ������Ԫ�ص�ԭ�Ӱ뾶
B.������Ӳ�ṹ��ͬ�ĵ������ӣ��뾶��ͬ
C.��������ͬ�IJ�ͬ�������ӣ�������Խ��뾶Խ��
D.ԭ������Խ��ԭ�Ӱ뾶Խ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���÷���м�Ʊ����Խ������ӣ���ȡ�������£�

����˵������ȷ����
A. ��Na2CO3��Һ������Ϊ�˳�ȥ����м���������
B. ͨ��N2�Ƿ�ֹ�����е�O2����������Ԫ��
C. ��������H2O2��Ϊ�˽�����Fe2+����ΪFe3+���漰��Ӧ��H2O2+2Fe2++2H+=2Fe3++2 H2O
D. ��ҺA��Fe2+��Fe3+��Ũ�ȱ�Ϊ2:1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com