
【题目】下列实验最终能看到白色沉淀的是( )
A.二氧化碳或二氧化硫通入氯化钙溶液中
B.过量二氧化碳通入澄清石灰水中
C.过量二氧化硫通入氢氧化钡溶液中
D.过量二氧化碳通入硅酸钠溶液中
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】以CH2=C(CH3)2和![]() 为原料可制备香料E(C11H12O2),其合成路线如下:
为原料可制备香料E(C11H12O2),其合成路线如下:
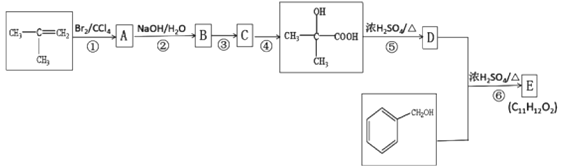
已知C 能发生银镜反应,D能使酸性高锰酸钾溶液褪色。请回答下列问题:
(1) 根据系统命名法有机物CH2=C(CH3)2的名称为___________;
(2) C 中能发生银镜反应的官能团名称是___________;
(3) ⑤的反应类型是_________;
(4) 写出⑥反应的化学方程式:__________________;
(5) 含苯环的![]() 的同分异构体有______种(不包含
的同分异构体有______种(不包含![]() ),其中核磁共振氢谱图有4 組峰且能与FeCl3溶液发生显色反应的有机物的结构简式为________;
),其中核磁共振氢谱图有4 組峰且能与FeCl3溶液发生显色反应的有机物的结构简式为________;
(6) 参照上述合成路线设计一条由乙烯制备聚乙二酸乙二酯的合成路线(无需注明反应条件)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料。工业上可用电子工业中刻蚀线路板的酸性废液(主要成分有FeCl3、CuCl2、FeCl2)制备,其制备过程如下:
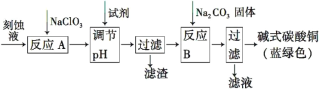
查阅资料知,通过调节溶液的酸碱性可使Cu2+,Fe2+,Fe3+生成沉淀的pH如下:
物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
开始沉淀pH | 4.7 | 7.5 | 1.4 |
沉淀完全pH | 6.7 | 14 | 3.7 |
(1)氯酸钠的作用是______________________________________。
(2)调节反应A所得溶液的pH范围为_______________________,
可以选择的试剂是______(填序号)。
a.氨水 b.硫酸铜 c.氢氧化铜 d.碱式碳酸铜
(3)反应B的温度要控制在60℃左右,且保持恒温,可采用的加热方法是________;若温度过高,所得蓝绿色沉淀中会有黑色固体出现,黑色固体可能是________。
(4)已知滤液中含有碳酸氢钠,写出生成碱式碳酸铜的离子方程式:______________________________________________。
(5)过滤得到的产品洗涤时,如何判断产品已经洗净____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列各物质按酸、碱、盐分类顺序排列,正确的是 ( )
A.盐酸、烧碱、胆矾B.硫酸、纯碱、食盐
C.碳酸、乙醇、醋酸钠D.磷酸、熟石灰、苛性钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.把100mL3mol·L-1的H2SO4跟100mL水混合,硫酸的物质的量浓度变为1.5 mol·L-1
B.把200mL3mol·L-1的BaCl2溶液跟100mL3mol·L-1的KCl溶液混合后,溶液中的c(Cl-)仍然是3mol·L-1
C.把100 g 20%的NaCl溶液跟100 g H2O混合后,NaCl溶液的质量分数是10%
D.1 L 水中溶解 0.2 mol 硝酸钾,即可配得 0.2 mol/L 硝酸钾溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O 晶体。(图中夹持及尾气处理装置均已略去)
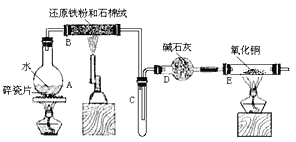
(1)烧瓶底部放置了几片碎瓷片,碎瓷片的作是 ________________。 装置B中发生反应的化学方程式是 ____________________________
(2)如果要在C中玻璃管处点燃该气体,则必须对该气体行________________,装置E中的现象是 _______________________________________
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法 _____________________________。
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
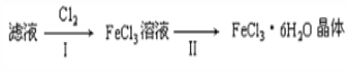
① 步骤I中通入Cl2的作用是__________________________________。
② 步骤II从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的量的说法中正确的是( )
A.物质的量是表示物质质量的物理量
B.物质的量是表示物质多少的物理量
C.物质的量是含有一定数目粒子集合体的物理量
D.物质的量既可表示物质的质量又可表示物质的数量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知五种元素的原子序数的大小顺序为C>A>B>D>E,A,C同周期,B,C同主族。A与B形成的离子化合物A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10个电子的分子。试回答下列问题:
(1)写出五种元素的元素符号:A:________、B:________、C:________、D:________、E:________。
(2)用电子式表示离子化合物A2B的形成过程:______________________。
(3)写出下列物质的电子式:
①D元素形成的单质:_______________________________________________。
②E与B形成的化合物:_____________________________________________。
③A,B,E形成的化合物:___________________________________________。
④D与E形成的化合物:______________________________________________。
⑤C,D,E形成的离子化合物:________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行铜与浓硫酸反应的实验。

请回答:
(1)铜与浓硫酸反应的化学方程式是______________________。
(2)实验中,观察到品红溶液_____________,石蕊溶液________________________。说明SO2_____________________。(填选项)
a.有氧化性b.有还原性c.有漂白性d.水溶液显酸性
(3)为进一步确认产生的气体是二氧化硫,还应补充的操作是_________________。
(4)试管D中氢氧化钠溶液的作用是__________,用离子方程式说明___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com