
【题目】某工厂的一个生产工艺流程如图所示,下列叙述正确的是( )
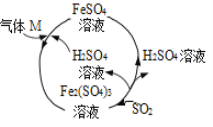
A. 该工艺流程的目的是制备 Fe2(SO4)3
B. 气体 M一定是 SO3
C. 气体 M 参加的反应是化合反应
D. SO2 参加反应时氧化剂和还原剂的物质的量之比是 1∶1
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、M、G、Q是六种短周期主族元素,原子序数依次增大。X、Z、Q的单质在常温下呈气态,Y的原子最外层电子数是其电子层数的2倍,X与M同主族,Z的气态氢化物能与其最高价氧化物的水化物反应,G是地壳中含量最高的金属元素。清回答下列问题:
(1)Q的元素符号为______,Y、Z、M、G四种元素原子半径由大到小的顺序是(写元素符号)_______。
(2)Y在元素周期表中的位置为_______________,Y与硫元素形成的二元化合物的电子式为_________________________。
(3)上述元素的最高价氧化物对应的水化物酸性最强的是(写化学式)_____________。
(4)单质Y和元素Z的最高价氧化物对应水化物的浓溶液发生反应的化学方程式为_________。
(5)Z和G组成的化合物GZ,被大量用于制造电子元件。工业上用G的氧化物、Y单质和Z单质在高温下制备GZ,其中G的氧化物和Y单质的物质的量之比为1∶3,则该反应的化学方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将含有C、H、O的有机物3.24 g,装入元素分析装置,通入足量的O2使它完全燃烧,将生成的气体依次通过氯化钙干燥管A和碱石灰干燥管B。测得A管质量增加了2.16g,B管增加了9.24g。经质谱法测得该有机物的相对分子质量为108。
(1)燃烧此化合物3.24g,须消耗O2的质量是多少______?
(2)求此化合物的分子式______。
(3)经红外光谱分析,该化合物分子中存在苯环和羟基,试写出其可能的结构简式______。
(4)进一步实验表明,该化合物的核磁共振氢谱存在四个峰,且峰面积之比为1:2:2:3,试确定该化合物的结构简式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料。工业上可用电子工业中刻蚀线路板的酸性废液(主要成分有FeCl3、CuCl2、FeCl2)制备,其制备过程如下:
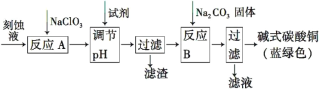
查阅资料知,通过调节溶液的酸碱性可使Cu2+,Fe2+,Fe3+生成沉淀的pH如下:
物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
开始沉淀pH | 4.7 | 7.5 | 1.4 |
沉淀完全pH | 6.7 | 14 | 3.7 |
(1)氯酸钠的作用是______________________________________。
(2)调节反应A所得溶液的pH范围为_______________________,
可以选择的试剂是______(填序号)。
a.氨水 b.硫酸铜 c.氢氧化铜 d.碱式碳酸铜
(3)反应B的温度要控制在60℃左右,且保持恒温,可采用的加热方法是________;若温度过高,所得蓝绿色沉淀中会有黑色固体出现,黑色固体可能是________。
(4)已知滤液中含有碳酸氢钠,写出生成碱式碳酸铜的离子方程式:______________________________________________。
(5)过滤得到的产品洗涤时,如何判断产品已经洗净____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,VL氨气溶解在1L水中(水的密度近似为lg/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质浓度为c mol/L,则下列关系中不正确的是
A. ρ=![]() B. ω=
B. ω=![]() C. ω=
C. ω=![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列各物质按酸、碱、盐分类顺序排列,正确的是 ( )
A.盐酸、烧碱、胆矾B.硫酸、纯碱、食盐
C.碳酸、乙醇、醋酸钠D.磷酸、熟石灰、苛性钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O 晶体。(图中夹持及尾气处理装置均已略去)
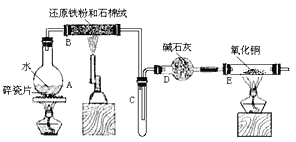
(1)烧瓶底部放置了几片碎瓷片,碎瓷片的作是 ________________。 装置B中发生反应的化学方程式是 ____________________________
(2)如果要在C中玻璃管处点燃该气体,则必须对该气体行________________,装置E中的现象是 _______________________________________
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法 _____________________________。
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
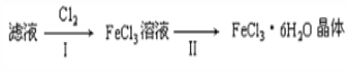
① 步骤I中通入Cl2的作用是__________________________________。
② 步骤II从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对乙烯基苯甲酸是重要的医药中间体,广泛应用于合成感光材料。对乙烯基苯甲酸可通过如下反应合成。
反应①: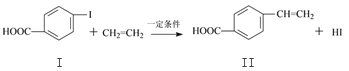
(1)下列关于化合物I和化合物Ⅱ的说法,正确的是______________。
a.化合物I能与新制的Cu(OH)2反应 b.均可发生酯化反应和银镜反应
c.化合物Ⅱ能使KMnO4溶液褪色 d.1 mol化合物Ⅱ最多能与5 mol H2反应
(2)化合物Ⅱ在催化剂条件下生成高分子化合物的反应方程式为_____________。
(3)化合物Ⅱ可由芳香族化合物Ⅲ通过消去反应获得,Ⅲ和Cu共热的产物能发生银镜反应,写出化合物Ⅲ的结构简式__________________________。
(4)化合物Ⅳ是化合物Ⅱ的同分异构体,且化合物Ⅳ遇FeCl3溶液显紫色,苯环上的一氯代物只有2种,写出化合物Ⅳ的结构简式________________________(写一种)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com