
【题目】化合物F是合成抗过敏药孟鲁斯特钠的重要中间体,其合成过程如下:

请回答下列问题:
(1)化合物C中含有氧官能团为________、________(填名称)。
(2)化合物B的分子式为C16H13O3Br,B的结构简式为________。
(3)由C→D、E→F的反应类型依次为________、________。
(4)写出符合下列条件C的一种同分异构体的结构简式________。
Ⅰ、属于芳香族化合物,且分子中含有2个苯环
Ⅱ、能够发生银镜反应
Ⅲ、分子中有5种不同环境的氢原子.
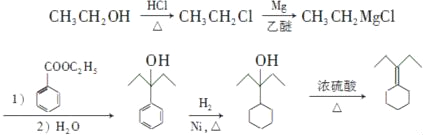
(5)已知:RCl![]() RMgCl,写出CH3CH2OH、
RMgCl,写出CH3CH2OH、![]() 为原料制备
为原料制备 的合成路线流程图(乙醚溶剂及无机试剂任用);________
的合成路线流程图(乙醚溶剂及无机试剂任用);________
合成路线流程图示例如下:H2C=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH.
CH3CH2OH.
【答案】羰基酯基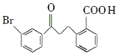 还原反应或加成反应取代反应
还原反应或加成反应取代反应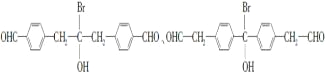
 ;
;
【解析】
B发生酯化反应生成C,根据C结构简式知,B结构简式为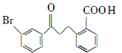 ,C发生加成反应生成D,D反应生成E,E发生取代反应生成F。
,C发生加成反应生成D,D反应生成E,E发生取代反应生成F。
(1)根据C结构简式知,化合物C中含有氧官能团为羰基、酯基,故答案为:羰基;酯基;
(2)化合物B的分子式为C16H13O3Br,B的结构简式为 ,故答案为:
,故答案为: ;
;
(3)通过以上分析知,C发生还原反应(或加成反应)生成D、E发生取代反应生成F,故答案为:还原反应(或加成反应);取代反应;
(4)C的同分异构体符合下列条件:Ⅰ、属于芳香族化合物,且分子中含有2个苯环;Ⅱ、能够发生银镜反应说明含有醛基;Ⅲ、分子中有5种不同环境的氢原子;符合条件的同分异构体结构简式为 、
、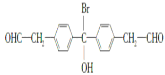 ,故答案为:
,故答案为: 、
、 ;
;
(5)CH3CH2OH和HCl发生取代反应生成CH3CH2Cl,CH3CH2Cl和Mg、乙醚反应生成CH3CH2MgCl,CH3CH2MgCl和苯甲酸乙酯、然后水解反应生成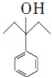 ,
, 和氢气发生加成反应生成
和氢气发生加成反应生成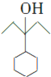 ,
, 发生消去反应生成
发生消去反应生成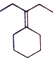 ,所以合成流程图为CH3CH2OH
,所以合成流程图为CH3CH2OH![]() CH3CH2Cl
CH3CH2Cl![]() CH3CH2MgCl
CH3CH2MgCl 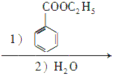
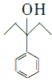
![]()
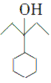
![]()
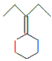 ,故答案为:CH3CH2OH
,故答案为:CH3CH2OH![]() CH3CH2Cl
CH3CH2Cl ![]() CH3CH2MgCl
CH3CH2MgCl

![]()

![]()
 。
。


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源: 题型:
【题目】(1)请用下列10种物质的序号填空:①O2②H2③NH4NO3④K2O2⑤Ba(OH)2⑥CH4⑦CO2⑧NaF ⑨NH3⑩I2
既有离子键又有非极性键的是________;既有离子键又有极性键的是________。
(2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,其电子式为:______________;若XY2为共价化合物时,其结构式为:__________________。
(3)氯化铝的物理性质非常特殊,如:氯化铝的熔点为190℃(2.02×103Pa),但在180℃就开始升华,据此判断,氯化铝是________(填“共价化合物”或“离子化合物”),可以证明你的判断正确的实验依据是____________________。
(4)现有a~g 7种短周期元素,它们在周期表中的位置如下,请据此回答下列问题:

①元素的原子间反应最容易形成离子键的是________(填序号,下同),容易形成共价键的是______;
A.c和f | B.b和g | C.d和g | D.b和e |
②写出a~g 7种元素形成的所有原子都满足最外层为8电子结构的任意一种分子的分子式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[物质结构与性质]已知:将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出深蓝色的晶体[Cu(NH3)4]SO4·H2O。硫酸铜溶液中滴入氨基乙酸钠(H2NCH2COONa)可得到如图1所示配合物A。

(1)Cu2+基态核外电子排布式为____________。
(2)N、O、S第一电离能由大到小的顺序为_________________。
(3)写出一种与NH3分子互为等电子体的阳离子:_________________。
(4)配合物A中碳原子的轨道杂化类型为_______________。
(5)1mol 氨基乙酸钠(H2NCH2COONa)含有σ键的数目为________。
(6)某含有结晶水的铜的氯化物的晶胞结构如图2所示,该金属氯化物的化学式是_____。(Cl-球的位置:4个在晶面上,2个在晶胞内)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述与胶体无关的是
A. 胶体分散质粒子直径大小在1100 nm之间
B. 当日光从窗隙射入暗室时,可观察到一束光线
C. 向氯化铁溶液中加入氢氧化钠溶液,产生红褐色沉淀
D. 胶体粒子具有较大的表面积,能吸附阳离子或阴离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C的原子序数逐渐增大,它们形成的离子均具有与氖原子相同的核外电子层结构。B和C的单质都能跟水剧烈反应,1molB单质跟水反应时,在标准状况下放出11.2LA的气态单质。1molC单质跟水反应时,在标准状况下放出11.2LH2,则:
(1)A、B、C三种元素原子半径由大到小的顺序_____。
(2)简单离子半径由大到小的顺序_______。
(3)写出A与C按原子个数1:1结合的电子式______。
(4)写出B与水反应生成A的化学方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化钠(NaH)是一种生氢剂,可发生反应:NaH+H2O=NaOH+H2↑,对这一反应的描述正确的是
A. NaH是氧化剂 B. 生成1 mol H2转移2 mol电子
C. NaOH是还原产物 D. 氧化产物和还原产物的质量比是1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。X原子最外层比次外层多3个电子;Y、Z均为金属,Y是同周期中原子半径最大的元素,Z的简单离子半径在同周期元素中最小;W的最高价氧化物在无机含氧酸中酸性最强。下列说法正确的是( )
A. X的气态氢化物的热稳定性比O(氧)的强
B. 元素Z、W的简单离子具有相同的电子层结构
C. Y、Z、W的最高价氧化物对应的水化物之间能相互反应
D. 等质量的Y和Z单质分别与足量稀盐酸反应,前者产生的氢气多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g)![]() CO2(g)+H2(g)△H>0
CO2(g)+H2(g)△H>0
试回答下列问题:
(1)请写出该化学反应的平衡常数表达式:___________。
(2)830K温度下,若起始时c(CO)=2mol·L-1,c(H2O)=3mol·L-1,达到平衡时CO的转化率为50%,则在该温度下,该反应的平衡常数K=______________
(3)若降低温度,该反应的K值将________,该反应的正反应速率将___________;该反应的逆反应速率将__________(均填“增大”“减小”或“不变”)。
(4)若要提高CO的转化率,可采取的措施有:___________。
(5)830K温度下,若起始时c(CO)=1mol·L-1,c(H2O)=2mol·L-1,反应进行一段时间后,测得H2的浓度为0.5mol·L-1,则此时该反应是否达到平衡状态___________(填“是”与“否”),你判断的依据是:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学已渗透到人类生活的各个方面。下列说法中错误的是
A.阿司匹林具有解热镇痛作用
B.可以用Si3N4制作高温结构陶瓷制品
C.在入海口的钢铁闸门上装一定数量的铜块可防止闸门被腐蚀
D.禁止使用四乙基铅作汽油抗爆震剂,可减少汽车尾气污染
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com