
【题目】白磷与氧气可发生如下反应:P4+5O2 = P4O10。已知断裂下列化学键需要吸收的能量分别为:E(P—P) = a kJ·mol-1、E(P—O) = b kJ·mol-1、E(P=O) = c kJ·mol-1、E(O=O) = d kJ·mol-1。根据图示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )
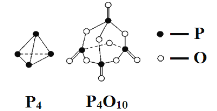
A.-(6a-12b-4c+5d)kJ·mol-1
B.-(-6a+12b+4c-5d)kJ·mol-1
C.-(-4a+6b+4c-5d)kJ·mol-1
D.-(4a-6b-4c+5d)kJ·mol-1
科目:高中化学 来源: 题型:
【题目】以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+等金属离子,通过添加过量难溶电解质MnS,可使这些金属离子形成硫化物沉淀,经过滤除去包括MnS在内的沉淀。根据上述实验事实,下列说法中,不正确的是
A.溶解度 MnS<PbS
B.MnS存在沉淀溶解平衡 MnS(s)![]() Mn2+(aq) + S2-(aq)
Mn2+(aq) + S2-(aq)
C.Cu2+转化为沉淀的原理为 MnS(s) + Cu2+(aq)=CuS(s) + Mn2+(aq)
D.沉淀转化能用于除去溶液中的某些杂质离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子一定能大量共存的是( )
A.在无色溶液中:NH4+、Fe2+、SO42﹣、CO32﹣
B.在含大量Ba2+的溶液中:NH4+、Na+、Cl﹣、OH﹣
C.在强碱溶液中:Na+、K+、Cl﹣、SO32﹣
D.在pH=1的溶液中:K+、Fe2+、Cl﹣、CH3COO﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在xR2++yH++O2═mR3++nH2O的离子方程式中,对系数m和R3+的判断正确的是( )
A.m=4,R3+是氧化产物
B.m=n,R3+是氧化产物
C.m=2,R3+是还原产物
D.m=y,R3+是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列仪器:烧杯、铁架台(带铁圈)、三角架、分液漏斗、酒精灯、玻璃棒、蒸发皿和蒸馏烧瓶,从缺少仪器的角度分析,不能进行的实验项目是( )
A. 过滤 B. 蒸发 C. 分液 D. 萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事故处理方法正确的是( )
A.汽油失火时,立即用水灭火
B.实验室不小心碰翻酒精灯引起实验桌上洒落的少量酒精起火时,迅速用泡沫灭火器灭火
C.浓硫酸溅到皮肤上,立即用稀 NaOH 溶液洗涤
D.浓 NaOH 溶液溅到皮肤上,立即用水冲洗,然后涂上稀硼酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应生成物Y浓度在2 min内由0变成了4 mol/L,则以Y表示该反应在2 min 内平均反应速率为
A. 8 mol/(L·min) B. 4 mol/(L·min) C. 2 mol/(L·min) D. 1 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(s)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。下列判断正确的是( )
A. 从开始到平衡A的平均反应速率为0.3 mol·L-1·s-1
B. 从开始到平衡B的转化率为60%
C. 此反应的化学平衡常数表达式K =![]()
D. 若混合气体的密度不再改变,则该反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固定容积为2L的密闭容器中发生反应xA(g)+yB(g)![]() zC(g),图I表示t℃时容器中各物质的量随时间的变化关系,图II表示平衡常数K随温度变化的关系。结合图像判断,下列结论正确的是( )
zC(g),图I表示t℃时容器中各物质的量随时间的变化关系,图II表示平衡常数K随温度变化的关系。结合图像判断,下列结论正确的是( )
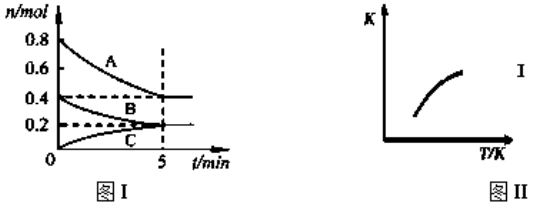
A.该反应可表示为:2A(g)+B(g)![]() C(g) ΔH﹤0
C(g) ΔH﹤0
B.t℃时该反应的平衡常数K=6.25
C.当容器中气体密度不再变化时,该反应达到平衡状态
D.t℃,在第6 min时再向体系中充入0.4 mol C,再次达到平衡时C的体积分数大于0.25
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com