
����Ŀ��һ�������£���3 mol A��1 mol B�����������ڹ̶��ݻ�Ϊ2 L���ܱ������У��������·�Ӧ��3A��g��+B��g�� xC��g��+2D��s����2 minĩ�÷�Ӧ�ﵽƽ�⣬����0.8 mol D�������C��Ũ��Ϊ0.2 mol��L-1�������ж���ȷ���ǣ� ��
A. �ӿ�ʼ��ƽ��A��ƽ����Ӧ����Ϊ0.3 mol��L-1��s-1
B. �ӿ�ʼ��ƽ��B��ת����Ϊ60%
C. �˷�Ӧ�Ļ�ѧƽ�ⳣ������ʽK =![]()
D. �����������ܶȲ��ٸı䣬��÷�Ӧ�ﵽƽ��״̬
���𰸡�D
�����������������A������A�����ʵ���Ϊ3��0.8/2mol=1.2mol��v��A��=1.2/��2��2��mol/��L��min��=0.3mol/��L��min�����ʴ���B������B�����ʵ���Ϊ0.8/2mol=0.4mol��B��ת����Ϊ0.4/1��100%=40%���ʴ���C�����ݷ�Ӧ����ʽ��x=2��0.2��2/0.8=1����ΪDΪ���壬����д����ѧƽ�ⳣ������ʽ��Ӧ��K=c��C��/[c3��A����c��B��]���ʴ���D�������ܶȵĶ��壬����������С���ǹ̶��ݻ�������������䣬���ܶȲ��ٸı䣬˵����Ӧ�ﵽƽ�⣬����ȷ��


 С��ʿ��ĩ����100��ϵ�д�
С��ʿ��ĩ����100��ϵ�д� ��У��ʦ������ҵ���Ӻ����Ծ�ϵ�д�
��У��ʦ������ҵ���Ӻ����Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״���һ�ֿ������������Դ,һ����������CO��H2�ϳ�CH3OH:CO��g��+2H2 ��g��![]() CH3OH��g��H =a kJ��mol-1�������Ϊ2 L���ܱ������г���2mol CO��4mol H2����ò�ͬ�¶������������������ʵ�����ʱ����min���ı仯��ϵ������ͼ��������������ʾ��
CH3OH��g��H =a kJ��mol-1�������Ϊ2 L���ܱ������г���2mol CO��4mol H2����ò�ͬ�¶������������������ʵ�����ʱ����min���ı仯��ϵ������ͼ��������������ʾ��
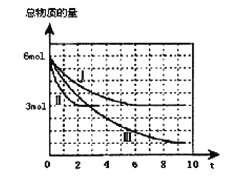
��1�����жϷ�Ӧ�ﵽ��ѧƽ��״̬���� ������ĸ����
A��c��CO����c��H2���ı�ֵ���ֲ���
B������������ѹǿ���ֲ���
C�������������ܶȱ��ֲ���
D����λʱ������1molCO���ĵ�ͬʱ��1mol CH3OH����
E��v����H2����2 v����CH3OH��
��2���٢������ȣ���ı�ķ�Ӧ������ ��
�ڷ�Ӧ����9minʱ�ﵽƽ�⣬�ȽϷ�Ӧ����¶���T1���ͷ�Ӧ����¶���T3���ĸߵͣ�T1 T3���>����<����=������������Ӧ��________��Ӧ������Ȼ����ȡ�����
��3���ٷ�Ӧ����6 minʱ�ﵽƽ�⣬�ӷ�Ӧ��ʼ���ﵽƽ��ʱv ��CH3OH�� = mol/��L��min����
�ڷ�Ӧ����2 minʱ�ﵽƽ�⣬������¶��µ�ƽ�ⳣ��K= ����������¶Ȳ���������£���������Ӧ�ﵽƽ���ʱ�����������м���1 mol CO��3 mol CH3OH����ƽ�⽫��_________�������Ӧ���淴Ӧ�Ͳ��ƶ�������ԭ����______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ɷ������·�Ӧ��P4��5O2 = P4O10����֪�������л�ѧ����Ҫ���յ������ֱ�Ϊ��E��P��P�� = a kJ��mol-1��E��P��O�� = b kJ��mol-1��E��P��O�� = c kJ��mol-1��E��O��O�� = d kJ��mol-1������ͼʾ�ķ��ӽṹ���й����ݹ���÷�Ӧ�Ħ�H��������ȷ������ ��
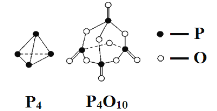
A������6a��12b��4c��5d��kJ��mol��1
B��������6a��12b��4c��5d��kJ��mol��1
C��������4a��6b��4c��5d��kJ��mol��1
D������4a��6b��4c��5d��kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������ϢϢ��أ�����˵������ȷ���ǣ� ��
A. ��ʳ�ɳ�ȥ��ˮ���ڱڵ�ˮ��
B. ��֬��������Ӧ����֬�����κͱ�����
C. ���ۡ���֬�������ʶ���ˮ�⣬��ˮ����ﲻͬ
D. ʯ�͵ķ���ú�ĸ���������Һ�����������仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʽΪC7H16�������У��ڽṹ��ʽ�к���3������ͬ���칹����Ŀ��
A��2�� B��3�� C��4�� D��5��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У�����������ԭ��Ӧ����ˮ�Ȳ������������ֲ�����ԭ������
A. Na2O+H2O=2NaOH B. 2F2+2H2O=4HF+O2
C. 3NO2+H2O=2HNO3+ NO D. 2Na+2H2O=2NaOH+H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڲ�ͬ״̬������̬����̬����������Ӧ���Ȼ�ѧ����ʽ������ʾ��
��H2��g����I2��?��![]() 2HI��g����H����9.48kJ��mol-1
2HI��g����H����9.48kJ��mol-1
��H2��g����I2��?��![]() 2HI��g����H����26.48kJ��mol-1
2HI��g����H����26.48kJ��mol-1
�����ж���ȷ������ ��
A�����е�I2Ϊ��̬�����е�I2Ϊ��̬
B�����ķ�Ӧ�������������ķ�Ӧ����������
C�����IJ���ȷ�Ӧ���IJ������ȶ��Ը���
D��1mol��̬������������17kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ��������¹ʴ�����ȷ���ǣ� ��
A. �������Ż�������ˮ����
B. ʵ����������촵��ƾ���
C. Ƥ���ϲ���մ��NaOH��Һ�������������ϴ
D. ϡ��Ũ����ʱ����Ũ��������������ע��ˮ�У������Ͻ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������軯���в���ֱ���ý������ʺ����ʷ�Ӧ�Ƶõ���
A��CuS B��FeS C��ZnS D��MgS
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com