
氯水中含有多种成分,具有多种性质,根据氯水分别与如图四种物质发生的反应填空(a、b、c、d重合部分代表物质间反应,且氯水足量)。

(1)能证明氯水具有漂白性的是__________(填“a”、“b”、“c”或“d”)。
(2)C过程中的现象是___________________,b过程中的离子方程式为_________________。
(3)a过程中的化学方程式为____________________________。
 星级口算天天练系列答案
星级口算天天练系列答案科目:高中化学 来源:2016届江苏省高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列指定反应的离子方程式正确的是
A.氯气溶于水:Cl2+H2O=2H++Cl-+ClO-
B.Na2CO3溶液中CO32-的水解:CO32-+H2O=HCO3-+OH-
C.酸性溶液中KIO3与KI反应生成I2:IO3-+I-+6H+=I2+3H2O
D.NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省高三上学期10月月考化学试卷(解析版) 题型:实验题
(14分)锗及其化合物被广泛应用于半导体、催化剂等领域。以铅锌矿含锗烟尘为原料可制备GeO2,其工艺流程图如下。
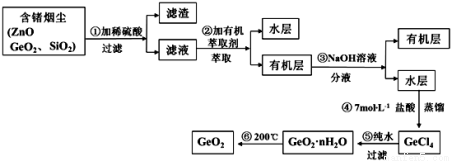
已知:GeO2是两性氧化物;GeCl4易水解,沸点86.6℃
(1)第①步滤渣主要成分有 (填化学式),实验室萃取操作用到的玻璃仪器有 。
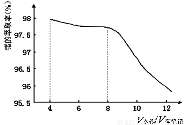
(2)第③步萃取时,锗的萃取率与V水相/V有机相(水相和有机相的体积比)的关系如下图所示,从生产成本角度考虑,较适宜的V水相/V有机相的值为 。
(3)第④步加入盐酸作用 (答两点即可)。
(4)第⑤步反应的化学方程式 。
(5)检验GeO2·nH2O是否洗涤干净的操作是 。
查看答案和解析>>
科目:高中化学 来源:2016届安徽省三校高三上学期二次模拟化学试卷(解析版) 题型:选择题
下列说法正确的是
A.用倾析法分离沉淀时,将烧杯中的上层清液用玻璃棒引流到另一容器内,即可使沉淀与清液分离
B.做“钠与水的反应”实验时,切取绿豆大小的金属钠,用滤纸吸干其表面的煤油,放入烧杯中,滴入两滴酚酞溶液,再加入少量水,然后观察并记录实验现象
C.过滤、结晶、灼烧、萃取、分液和蒸馏等都是常用的分离有机混合物的方法
D.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高二上第一次月考化学试卷(解析版) 题型:填空题
(10分)科学家从化肥厂生产的(NH4)2SO4中检出组成为N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以SO42-和N4H44+两种离子形式存在,植物的根系易吸收N4H44+,但它遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。
请回答下列问题:
(1)N4和N2的关系正确的是 (填序号)。
A.同种单质 B.同位素 C.同分异构体 D.同素异形体
(2)N4H4(SO4)2 (填“能”或“不能”)和草木灰混合施用。
(3)已知断裂1molN—N吸收167kJ热量,生成1molN N放出942kJ。写出N4气体转变为N2的热化学方程式: 。
(4)已知白磷、NH4+、N4H44+的空间构型均为四面体,NH4+的结构式为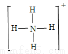 ,白磷(P4)的结构式为
,白磷(P4)的结构式为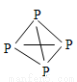 ,请画出N4H44+的结构式 。
,请画出N4H44+的结构式 。
(5)已知液氨中存在着平衡2NH3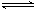 NH4++NH2-。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子和另一种单质气体,请写出液氨与氢氧化铯反应的化学方程式: 。
NH4++NH2-。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子和另一种单质气体,请写出液氨与氢氧化铯反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省高一上期中测试化学试卷(解析版) 题型:选择题
下列实验操作或结论正确的是
A.在某溶液中加入AgNO3溶液有白色沉淀产生,再加盐酸,沉淀不消失,则该溶液中一定有Cl-
B.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有C032-
C.做焰色反应前应先将铂丝在稀硫酸中洗干净再蘸取待测液进行实验
D.如透过蓝色的钴玻璃能够观察到紫色火焰,则肯定有K元素,可能有Na元素
查看答案和解析>>
科目:高中化学 来源:2016届福建省大田市高三上学期第一次月考化学试卷(解析版) 题型:选择题
将氯水分别滴入下列各选项所述的溶液中,由实验现象得出的结论完全正确的是
选项 | 氯水滴入下列溶液中 | 实验现象 | 结论 |
A | 滴有KSCN的FeCl2溶液 | 变血红 | Cl2具有还原性 |
B | 滴有酚酞的NaOH溶液 | 褪色 | Cl2具有漂白性 |
C | 紫色石蕊溶液 | 先变红后褪色 | Cl2具有酸性、漂白性 |
D | KI淀粉溶液 | 变蓝色 | Cl2具有氧化性 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省高二上学期第一次月考化学试卷(解析版) 题型:选择题
在密闭容器中,反应2X(g)+ Y2(g)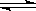 2XY(g);△H<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,下列分析正确的是
2XY(g);△H<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,下列分析正确的是
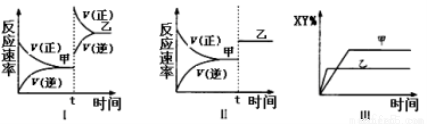
A.图I中,甲、乙的平衡常数分别为K1、K2,则K1=K2
B.图Ⅱ中,平衡状态甲与乙相比,平衡状态甲的反应物转化率低
C.图Ⅱ中,t时间是增大了压强
D.图Ⅲ是反应分别在甲、乙条件下达到平衡,说明甲温度高于乙
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高二上期中选修化学试卷(解析版) 题型:填空题
(18分)合成氨是人类科学技术上的一项重大突破。工业上以天然气为原料合成氨。其生产工艺如下:造气阶段→转化阶段→分离净化→合成阶段
(1)造气阶段的反应为:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+206.1 kJ/mol
CO(g)+3H2(g) ΔH=+206.1 kJ/mol
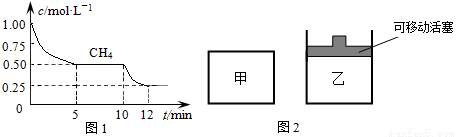
①在一密闭容器中进行上述反应,测得 CH4的物质的量浓度随反应时间的变化如下图1所示。反应中处于平衡状态的时间为 、 ;10 min时,改变的外界条件可能是 。
②如图2所示,在初始容积相等的甲、乙两容器中分别充入等物质的量的CH4和H2O。在相同温度下发生反应,并维持反应过程中温度不变。则达到平衡时,两容器中CH4的转化率大小关系为:α甲(CH4) α乙(CH4);
(2)转化阶段发生的可逆反应为: CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
一定温度下,反应的平衡常数为K=1。某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
CO | H2O | CO2 | H2 |
0.5 mol | 8.5 mol | 2.0 mol | 2.0 mol |
此时反应中正、逆反应速率的关系式是 (填序号)。
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断
(3)合成氨反应为:N2(g)+3H2(g)  2NH3(g) ∆H=-92.4kJ•mol ?1
2NH3(g) ∆H=-92.4kJ•mol ?1
①依据温度对合成氨反应的影响,在下图坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。
②根据勒夏特列原理,简述提高合成氨原料转化率的一种方法 。

(4)工业合成氨的热化学方程式为
N2(g)+3H2(g)  2NH3(g),ΔH=-92.4 kJ·mol-1。
2NH3(g),ΔH=-92.4 kJ·mol-1。
在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。求:
①该条件下的平衡常数为_________;
②若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均大于0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同。反应放出的热量________(填“>”“<”或“=”)92.4 kJ。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com