
如图1所示为化学实验中所用的喷泉装置.在烧瓶中充满干燥的气体,胶头滴管及烧杯中盛有液体.下列组合中不可能形成喷泉的是

[ ]
|
A.HCl和H2O |
B.O2和H2O |
|
C.NH3和H2O |
D.CO2和NaOH溶液 |
某学生积极思考产生喷泉的其他方法,并设计了如图2所示的装置.
(1)在如图2所示的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是
[ ]
|
A.Cu和稀盐酸 |
B.NaHCO3和NaOH |
|
C.CaCO3和稀硫酸 |
D.NaHCO3和稀盐酸 |
(2)在如图2所示锥形瓶中放入酒精,锥形瓶放入水槽中.水槽中加入水后,再加入下列物质.结果也产生了喷泉.水槽中加入的物质可以是
[ ]
|
A.浓硫酸 |
B.食盐 |
|
C.硝酸钾 |
D.硫酸铜 |
这种方法产生喷泉的原因是________.
(3)比较如图1和图2两套装置,从产生喷泉的原理来分析,图1是________上部烧瓶内气体的压强;图2是________下部锥形瓶内气体的压强(填“增大”、“减小”).
(4)城市中常见的人造喷泉及火山爆发的原理与上述________(填图1或图2)装置的原理相同.
|
B;(1)D;(2)A,浓H2SO4溶于水放热使锥形瓶温度升高,酒精挥发,锥形瓶内压力增大;(3)减小,增大;(4)图2 【巧解导析】本题进一步考查喷泉产生的原因和学生对有关问题深入探究的态度.善于思考的学生在完成了实验后就会有这样的认识:NH3和HCl均易溶于水而形成喷泉,其实质是NH3或HCl溶解于水后使烧瓶内气体的压强减小,在大气压的作用下,将烧杯内的液体压入烧瓶.因而图1中只要满足气体易溶并产生较大压力差就可形成喷泉.而图2则要求增大锥形瓶内的气体压强并将液体压入烧瓶形成喷泉. |
|
【巧解点悟】认识喷泉现象的实质不仅要气体溶解度大,而且一定要产生足够大的压强差.要防止忽略导管长度及大气压作用的情况发生. |


科目:高中化学 来源: 题型:
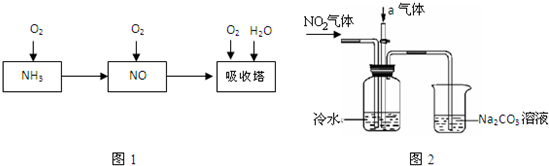
| ||
| △ |
| ||
| △ |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 加热 |
| 加热 |
| 加热 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
| 高温、高压 |
| 催化剂 |
| 高温、高压 |
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ”表示),设计一套原电池装置,并验证有电流产生,请帮他在图2方框内补充全装置简图(要求标注正、负极及其材料和电解质溶液名称).
”表示),设计一套原电池装置,并验证有电流产生,请帮他在图2方框内补充全装置简图(要求标注正、负极及其材料和电解质溶液名称).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com