某化学兴趣小组使用酸碱中和滴定法测定市售白醋(主要成分为CH
3COOH)的总酸量(g/100ml).
Ⅰ、实验步骤:
(1)量取10.00mL食用白醋,在烧杯中用水稀释后转移到100ml容量瓶中定容,摇匀即得待测白醋溶液.
(2)用酸式滴定管取待测白醋溶液20.00ml于锥形瓶中,向其中滴加2滴酚酞作指示剂.
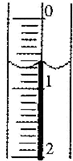
(3)读取盛装0.1000mol/L溶液的碱式滴定管的初始读数.如果液面位置如右图所示,则此时的读数为
ml.
(4)滴定.当溶液由无色变为粉红色并在半分钟内不褪色时,停止滴定,并记录NaOH溶液的最终读数.重复滴定3次.
Ⅱ.实验记录
| 实验数据(mL)/滴定次数 |
1 |
2 |
3 |
4 |
| V(样品) |
20.00 |
20.00 |
20.00 |
20.00 |
| V(NaOH)(消耗) |
15.95 |
15.00 |
15.05 |
14.95 |
Ⅲ.数据处理与讨论:
(1)甲同学按正确数据处理,可算得市售白醋总酸量=
g/100ml.
(2)乙同学仔细研究了该品牌白醋的标签,发现其中还含有某种一元弱酸的钠盐)作为食品添加剂,他想查阅资料证明醋酸与钠盐不会发生反应生成弱酸HR,需查找在一定温度下的醋酸与该弱酸的
(填写序号).
A.密度 B.沸点 C.电离常数 D.溶解度
(3)在本实验的滴定过程中,下列操作会使实验结果偏大的是
(填写序号).
a.碱式滴定管在装液前未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,在加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出.

 某化学兴趣小组使用酸碱中和滴定法测定市售白醋(主要成分为CH3COOH)的总酸量(g/100ml).
某化学兴趣小组使用酸碱中和滴定法测定市售白醋(主要成分为CH3COOH)的总酸量(g/100ml).

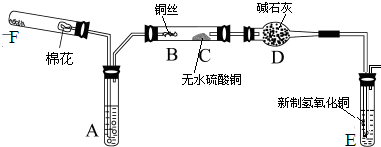


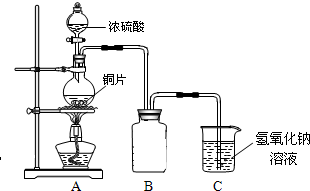 (2011?绵阳模拟)某化学兴趣小组为探究
(2011?绵阳模拟)某化学兴趣小组为探究