
【题目】化学在生产和日常生活中有着重要的应用。下列叙述正确的是( )
A.白酒中混有少量塑化剂,少量饮用对人体无害,可通过过滤方法除去
B.“辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料
C.SiCl4在战争中常用作烟雾弹,是因为它水解时生成白色烟雾
D.“雾霾天气”、“温室效应”、“光化学烟雾”的形成都与氮氧化物无关
科目:高中化学 来源: 题型:
【题目】纯净的水呈中性,这是因为( )
A. 纯水中c(H+)= c(OH-) B. 纯水PH=7
C. 纯水的离子积KW=1.0×10-14 D. 纯水中无H+也无OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关生物体细胞组成元素的叙述,错误的是
A. 在不同生物的体细胞内,组成它们的化学元素种类大体相同
B. 组成细胞的最基本元素是C
C. 在同一生物的不同体细胞内,各种化学元素的含量相同
D. 组成生物体细胞的化学元素,在无机自然界中都能找到
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ. 制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60 ℃时NaClO2分解成NaClO3和NaCl。现利用下图所示装置进行实验。

(1) 装置②中产生ClO2气体的化学方程式为 ;
装置④中制备NaClO2的化学方程式为 。
(2) 装置③的作用是 。
(3) 从装置④反应后的溶液获得NaClO2晶体的操作步骤如下:
①减压,55℃蒸发结晶;②趁热过滤;③ ;④低于60 ℃干燥,得到成品。
实验II. 测定某亚氯酸钠样品的纯度
设计如下实验方案,并进行实验:
①称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2+4I+4H+==2H2O+2I2+Cl);将所得混合液配成250 mL待测溶液。
②移取25.00 mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为V mL(已知:I2+2S2O32=2I+S4O62)。
(4) 达到滴定终点时的现象为 。
(5) 该样品中NaClO2的质量分数为 (用含m、c、V的代数式表示)。
(6) 在滴定操作正确无误的情况下,此实验测得结果偏高,原因用离子方程式表示为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验原理、方法和结论都正确的是
A.向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体
B.取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+
C.室温下向苯和少量苯酚的混合溶液中加入适量NaOH溶液,振荡、静置后分液,可除去苯中少量苯酚
D.已知I3-![]() I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾广泛应用于净水、电池工业等领域。工业上以钛白粉生产的副产品FeSO4制备高铁酸钾的生产流程如下:

查资料得知K2FeO4的一些性质:
①在碱性环境中稳定,在中性和酸性条件下不稳定。
②在水中溶解度很大,难溶于无水乙醇等有机溶剂。
回答下列问题:
(1)写出氧化I中,生成Fe3+的离子反应方程式:
(2)氧化II中,试剂A为 (填“H2O2”或“HNO3”或“NaC1O”),反应的离子方程式为_____________________。
(3)操作I中包括冷却结晶,过滤洗涤、干燥几个步骤,洗涤干燥的目的是脱碱脱水,进行洗涤操作时应该用 洗涤。
(4)净水时高铁酸钾能逐渐与水反应生成絮状的Fe(OH)3,请补充并配平该反应方程式的系数及产物:
______K2FeO4 + H2O ![]() Fe(OH)3(胶体)+ KOH + 。
Fe(OH)3(胶体)+ KOH + 。
将一定量的K2FeO4投入一定浓度的FeC13溶液中,测得剩余K2FeO4浓度如下图所示,推测产生曲线I和曲线II差异的原因是: 。

(5)制得的粗K2FeO4产品中常混有少量KCl。取5.0 g粗产品溶于足量稀硝酸,充分反应后,加入足量的硝酸银,过滤得到沉淀,洗涤、干燥,称量得到1.435 g固体,K2FeO4的质量分数为___________。(可能用到的相对原子质量:O 16 Cl 35.5 K 39 Fe 56 Ag 108)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2011年12月30日中国环境保护部通过了新修订的《环境空气质量标准》,调整了污染物项目及限值,增设了PM2.5平均浓度限值,收紧了NO2等污染物的浓度限值。
(1)①甲烷是一种清洁燃料,在一定条件下,发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH>0。将1.0 mol CH4和2.0 mol H2O通入反应容器(假设容积为10L),10 min末有0.10 mol CO生成,则10 min内该反应的速率v(H2)= 。②已知甲烷燃料电池的工作原理如右图所示。该电池中甲烷从 进(填“a”、“b”、“c”、“d”),电极Ⅰ是 极,写出该电池负极的电极反应: 。
CO(g)+3H2(g) ΔH>0。将1.0 mol CH4和2.0 mol H2O通入反应容器(假设容积为10L),10 min末有0.10 mol CO生成,则10 min内该反应的速率v(H2)= 。②已知甲烷燃料电池的工作原理如右图所示。该电池中甲烷从 进(填“a”、“b”、“c”、“d”),电极Ⅰ是 极,写出该电池负极的电极反应: 。

(2)某工厂利用尾气CO制甲醇,在一定压强和固定容积的容器中,通入a molCO与2a mol H2,在催化剂作用下反应:CO(g)+2H2(g) ![]() CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:
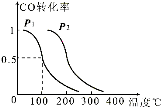
①P1 P2(填“<”、“>”或“=”)。
②下列各项中,不能说明该反应已达到平衡的是 。
a.恒温、恒容条件下,容器内的压强不发生变化
b.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
c.一定条件下,CO、H2和CH3OH的浓度保持不变
d.一定条件下,单位时间内消耗1 mol CO,同时生成l mol CH3OH
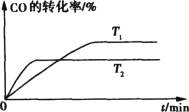
③如下图是该反应在不同温度下CO的转化率随时间变化的曲线。请分别画出在T1 、T2温度下,H2的浓度随时间变化的曲线
(3)某硝酸处理NO2方法是:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g)+O2(g)=2H2O(g)![]() =-483.6kJ/mol
=-483.6kJ/mol
N2(g)+2O2(g)=2NO2(g)![]() =+67.7kJ/mol
=+67.7kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.物质的量是用来研究微观粒子的一个国际基本物理量,其单位是摩尔
B.气体的摩尔体积与温度和压强有关,压强越大,体积越大
C.若x个N (氮)原子的质量是1 g,则阿伏加德罗常数可表示为14 x mol-1
D.任何一种微观粒子,当摩尔质量以gmol-1为单位时,其数值与这种粒子的相对分子质量或相对原子质量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.12g铁粉加入25mL 2molL﹣1的氯化铁溶液中,充分反应后,其结果是( )
A.铁有剩余,溶液呈浅绿色,Cl﹣浓度基本不变
B.往溶液中滴入无色KSCN溶液,显黄色
C.Fe2+和Fe3+的物质的量之比为6:1
D.氧化产物与还原产物的物质的量之比为2:5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com