
【题目】高铁酸钾广泛应用于净水、电池工业等领域。工业上以钛白粉生产的副产品FeSO4制备高铁酸钾的生产流程如下:

查资料得知K2FeO4的一些性质:
①在碱性环境中稳定,在中性和酸性条件下不稳定。
②在水中溶解度很大,难溶于无水乙醇等有机溶剂。
回答下列问题:
(1)写出氧化I中,生成Fe3+的离子反应方程式:
(2)氧化II中,试剂A为 (填“H2O2”或“HNO3”或“NaC1O”),反应的离子方程式为_____________________。
(3)操作I中包括冷却结晶,过滤洗涤、干燥几个步骤,洗涤干燥的目的是脱碱脱水,进行洗涤操作时应该用 洗涤。
(4)净水时高铁酸钾能逐渐与水反应生成絮状的Fe(OH)3,请补充并配平该反应方程式的系数及产物:
______K2FeO4 + H2O ![]() Fe(OH)3(胶体)+ KOH + 。
Fe(OH)3(胶体)+ KOH + 。
将一定量的K2FeO4投入一定浓度的FeC13溶液中,测得剩余K2FeO4浓度如下图所示,推测产生曲线I和曲线II差异的原因是: 。

(5)制得的粗K2FeO4产品中常混有少量KCl。取5.0 g粗产品溶于足量稀硝酸,充分反应后,加入足量的硝酸银,过滤得到沉淀,洗涤、干燥,称量得到1.435 g固体,K2FeO4的质量分数为___________。(可能用到的相对原子质量:O 16 Cl 35.5 K 39 Fe 56 Ag 108)
【答案】
(1)H2O2+2H++2Fe2+=2Fe3++2H2O;
(2)NaClO;2Fe3++3ClO-+10OH-=2FeO42-+5H2O+3Cl-;
(3)无水乙醇;
(4)4;10;4;8;3O2↑;FeCl3溶液水解显酸性,促进K2FeO4与水反应从而降低K2FeO4的浓度;
(5)85.1%;
【解析】
试题分析:(1)氧化I中,双氧水将亚铁离子氧化生成Fe3+的离子反应方程式为H2O2+2H++2Fe2+=2Fe3++2H2O,故答案为:H2O2+2H++2Fe2+=2Fe3++2H2O;
(2)氧化II中,试剂A将Fe3+氧化为FeO42-,结合题意和信息,应该选用NaC1O,防止生成的K2FeO4分解,反应的离子方程式为2Fe3++3ClO- +10OH- = 2FeO42- + 5H2O + 3Cl-,故答案为:NaClO;2Fe3++3ClO- +10OH- = 2FeO42- + 5H2O + 3Cl- ;
(3)根据信息,K2FeO4在水中溶解度很大,难溶于无水乙醇等有机溶剂。操作I应该选用无水乙醇进行洗涤,故答案为:无水乙醇;
(4)净水时高铁酸钾能逐渐与水反应生成絮状的Fe(OH)3,根据得失电子守恒,配平后的方程式为4K2FeO4 +10H2O ![]() 4Fe(OH)3(胶体)+8KOH + 3O2↑;将一定量的K2FeO4投入一定浓度的FeC13溶液中,由于FeCl3溶液水解显酸性,促进K2FeO4与水反应从而降低K2FeO4的浓度,故答案为:4;10;4;8;3O2↑;FeCl3溶液水解显酸性,促进K2FeO4与水反应从而降低K2FeO4的浓度;
4Fe(OH)3(胶体)+8KOH + 3O2↑;将一定量的K2FeO4投入一定浓度的FeC13溶液中,由于FeCl3溶液水解显酸性,促进K2FeO4与水反应从而降低K2FeO4的浓度,故答案为:4;10;4;8;3O2↑;FeCl3溶液水解显酸性,促进K2FeO4与水反应从而降低K2FeO4的浓度;
(5)生成氯化银的质量为1.435 g,物质的量为![]() =0.01mol,可以氯化钾的质量为0.01mol×74.5g/mol=0.745g,K2FeO4的质量分数为
=0.01mol,可以氯化钾的质量为0.01mol×74.5g/mol=0.745g,K2FeO4的质量分数为![]() ×100%=85.1%,故答案为:85.1%。
×100%=85.1%,故答案为:85.1%。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】标准状况下,m g气体A与n g气体B的分子数目一样多,下列说法不正确的是( )
A. 在任意条件下,若两种分子保持原组成,则其相对分子质量之比为m∶n
B. 25 ℃、1.25×105 Pa时,两气体的密度之比为n∶m
C. 同质量的A、B在非标准状况下,其分子数之比为n∶m
D. 相同状况下,同体积的气体A与B的质量之比为m∶n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合化铝是一种新型、高效絮凝剂和净水剂,其单体是液态的碱式氯化铝Al2(OH)nCl6-n。本实验采用铝盐溶液水解絮凝法制备碱式氯化铝。其制备原料为分布广、价格廉的高岭土,化学组成为:Al2O3(25%~34%)、SiO2(40%~50%)、Fe2O3(0.5%~3.0%)以及少量杂质和水分。已知氧化铝有多种不同的结构,化学性质也有差异,且一定条件下可相互转化;高岭土中的氧化铝难溶于酸。制备碱式氯化铝的实验流程如下:
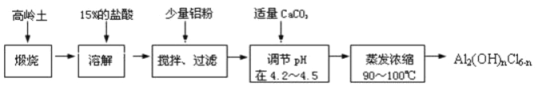
根据流程图回答下列问题:
(1)“煅烧”的目的是 。
(2)配制质量分数15%的盐酸需要200ml30%的浓盐酸(密度约为1.15g·cm-3)和 g蒸馏水,配制用到的仪器有 。
(3)“溶解”过程中发生反应的离子方程式为 。
(4)加少量铝粉的主要作用是 。
(5)“蒸发浓缩”需保持温度在90~100℃,控制温度的实验方法是 。
(6)若溶解过程改为加入一定浓度的氢氧化钠溶液,发生反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列仪器在测定稀盐酸和氢氧化钠稀溶液中和反应反应热的实验中没有使用到的是( )
①大、小烧杯 ②容量瓶 ③量筒 ④环形玻璃搅拌棒
⑤试管 ⑥温度计 ⑦蒸发皿 ⑧托盘天平
A. ①②⑥⑦ B. ②⑤⑦⑧
C. ②③⑦⑧ D. ③④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在生产和日常生活中有着重要的应用。下列叙述正确的是( )
A.白酒中混有少量塑化剂,少量饮用对人体无害,可通过过滤方法除去
B.“辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料
C.SiCl4在战争中常用作烟雾弹,是因为它水解时生成白色烟雾
D.“雾霾天气”、“温室效应”、“光化学烟雾”的形成都与氮氧化物无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中的主要污染物是NO和CO。为减轻大气污染,人们提出通过以下反应来处理汽车尾气:
(1)2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)△H=﹣746.5kJmol-1(条件为使用催化剂)
2CO2(g)+N2(g)△H=﹣746.5kJmol-1(条件为使用催化剂)
已知:2C(s)+O2(g)![]() 2CO(g)△H=﹣221.0kJmol-1
2CO(g)△H=﹣221.0kJmol-1
C(s)+O2(g)![]() CO2(g)△H=﹣393.5kJmol-1
CO2(g)△H=﹣393.5kJmol-1
则N2(g)+O2(g)=2NO(g) △H = kJmol-1。
(2)T ℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/10-4 mol/L | 10.0 | 4.50 | c1 | 1.50 | 1.00 | 1.00 |
c(CO)/10-3 mol/L | 3.60 | 3.05 | c2 | 2.75 | 2.70 | 2.70 |
则c2合理的数值为 (填字母标号)。
A.4.20 B.4.00 C.2.95 D.2.80
(3)将不同物质的量的H2O(g)和CO(g)分别通入体积为2 L的恒容密闭容器中,进行反应:H2O(g)+CO(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | CO | H2 | |||
i | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
ii | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
iii | 900 | a | b | c | d | t |
若a=2,b=1,则c= ,达平衡时实验组ii中H2O(g)和实验组iii中CO的转化率的关系为αii(H2O) αiii(CO)(填“<”、“>”或“=”)。
(4)二甲醚是清洁能源,用CO在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、投料比
CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、投料比![]() 的变化曲线如图1所示。
的变化曲线如图1所示。
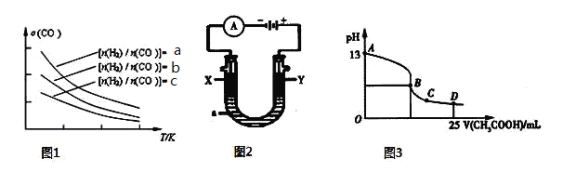
① a、b、c按从大到小的顺序排序为 。
② 根据图象可以判断该反应为 反应(填吸热或放热)。
(5)CO分析仪的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似于燃料电池,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,能传导O2-。
① 负极的电极反应式为 。
② 以上述电池为电源,通过导线连接成图2。若X、Y为石墨,a为2 L 0.1 mol/L KCl溶液电解一段时间后,取25 mL 上述电解后的溶液,滴加0.4 mol/L醋酸得到图3曲线(不考虑能量损失和气体溶于水,溶液体积变化忽略不计)。根据图2计算,上述电解过程中消耗一氧化碳的质量为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将金属a放入b(NO3)2溶液中发生如下反应:a+b2+===a2++b,则下列说法正确的是( )
A.常温下,a或b可以与水发生反应
B.a与b用导线连接插入稀H2SO4中,则形成原电池且b极上有H2放出
C.a与b用导线连接插入b(NO3)2溶液中一定构成原电池
D.用惰性电极电解a(NO3)2与b(NO3)2的混合液,在阳极先析出b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2N2O5(g)=4NO2(g)+O2(g) △H=+56.8kJ/mol自发进行的原因
A. 是吸热反应; B. 是放热反应;
C. 是熵减少的反应; D. 熵增大效应大于能量效应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有50 mL NaOH溶液,向其中逐渐通入一定量的CO2,随后取此溶液10 mL将其稀释至100 mL,并向此稀释后的溶液中逐滴加入0.1 mol·L-1的HCl溶液,产生CO2气体的体积(标准状况)与所加入盐酸的体积之间的关系如下图所示:
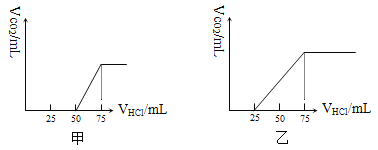
(1)甲溶液中的溶质是_____________,其物质的量之比为__________________。
(2)乙溶液中的溶质是_____________,在标准状况下吸收CO2气体的体积为________。
(3)原NaOH溶液的物质的量浓度为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com