
����Ŀ������β���е���Ҫ��Ⱦ����NO��CO��Ϊ���������Ⱦ���������ͨ�����·�Ӧ����������β����
��1��2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)��H=��746.5kJmol��1������Ϊʹ�ô�����
2CO2(g)+N2(g)��H=��746.5kJmol��1������Ϊʹ�ô�����
��֪��2C(s)+O2(g)![]() 2CO(g)��H=��221.0kJmol��1
2CO(g)��H=��221.0kJmol��1
C(s)+O2(g)![]() CO2(g)��H=��393.5kJmol��1
CO2(g)��H=��393.5kJmol��1
��N2(g)+O2(g)=2NO(g) ��H = kJmol��1��
��2��T ��������һ�ݻ�������ܱ���������ͨ��һ������NO��CO�������崫������ò�ͬʱ��NO��CO��Ũ�����±�
ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/10��4 mol/L | 10.0 | 4.50 | c1 | 1.50 | 1.00 | 1.00 |
c(CO)/10��3 mol/L | 3.60 | 3.05 | c2 | 2.75 | 2.70 | 2.70 |
��c2��������ֵΪ ������ĸ��ţ���
A��4.20 B��4.00 C��2.95 D��2.80
��3������ͬ���ʵ�����H2O(g)��CO(g)�ֱ�ͨ�����Ϊ2 L�ĺ����ܱ������У����з�Ӧ��H2O(g)+CO(g)![]() CO2(g)+H2(g)���õ������������ݣ�
CO2(g)+H2(g)���õ������������ݣ�
ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
H2O | CO | CO | H2 | |||
i | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
ii | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
iii | 900 | a | b | c | d | t |
��a=2��b=1����c= ����ƽ��ʱʵ����ii��H2O(g)��ʵ����iii��CO��ת���ʵĹ�ϵΪ��ii��H2O�� ��iii��CO�������������������=������
��4���������������Դ����CO�ڴ����������Ʊ������ѵķ�Ӧԭ��Ϊ��2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g)����֪һ�������£��÷�Ӧ��CO��ƽ��ת�������¶ȡ�Ͷ�ϱ�
CH3OCH3(g)+H2O(g)����֪һ�������£��÷�Ӧ��CO��ƽ��ת�������¶ȡ�Ͷ�ϱ�![]() �ı仯������ͼ1��ʾ��
�ı仯������ͼ1��ʾ��
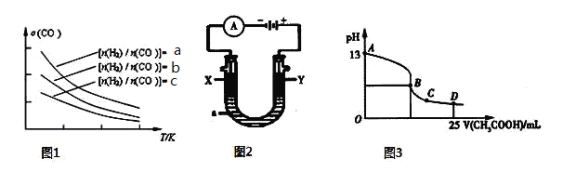
�� a��b��c���Ӵ�С��˳������Ϊ ��
�� ����ͼ������жϸ÷�ӦΪ ��Ӧ�������Ȼ���ȣ���
��5��CO�����ǵĴ������ɲⶨ����β���Ƿ�����ŷű����÷����ǵĹ���ԭ��������ȼ�ϵ�أ����е�����������ƣ�Y2O3��������ﯣ�ZrO2�����壬�ܴ���O2����
�� �����ĵ缫��ӦʽΪ ��
�� ���������Ϊ��Դ��ͨ���������ӳ�ͼ2����X��YΪʯī��aΪ2 L 0.1 mol/L KCl��Һ���һ��ʱ���ȡ25 mL �����������Һ���μ�0.4 mol/L����õ�ͼ3���ߣ�������������ʧ����������ˮ����Һ����仯���Բ��ƣ�������ͼ2���㣬����������������һ����̼������Ϊ g��
���𰸡�
��1��+180.5��2��D��3��0.6 =
��4����a��b��c�ڷ��ȣ�1�֣�
��5����CO+2O2����2e��=CO32����2.8g
��������
�����������1������֪�ʱ���Ȼ�ѧ����ʽ���Ϊ�٢ڢ���δ֪��Ϊ�����۲췢������+�ۡ�2���ڡ�2=�ܣ��������H=��������H+������H��2��������H��2 = [��(��746.5)+(��393.5)��2�� (��221.0)��2]kJmol��1 = +180.5 kJmol��1����2��A�����ŷ�Ӧ�Ľ��У�c(CO)��С����4.20>3.05��A����B�����ŷ�Ӧ�Ľ��У�c(CO)��С����4.00>3.05��B����C�����ŷ�Ӧ�Ľ��У���CO��ʾ�ķ�Ӧ������С������1��2sʱv(CO) > ��2��3sʱv(CO) > ��3��4sʱv(CO)����c2=2.95��Υ���������ɣ�C�������ŷ�Ӧ�Ľ��У�CO�ķ�Ӧ������С��c2=2.80ʱ����1��2sʱv(CO) > ��2��3sʱv(CO) > ��3��4sʱv(CO)��D��ȷ����ѡD����3��ʵ��ii��iii���¶���ͬ�����ƽ�ⳣ��������ʽ�з��ӡ���ĸ����ͬ��������ʽ����֪��
H2O(g) + CO(g) ![]() CO2(g) + H2(g)
CO2(g) + H2(g)
��ʼn/mol 1 2 0 0
�仯n/mol 0.4 0.4 0.4 0.4
ƽ��n/mol 0.6 1.6 0.4 0.4
ʵ��ii����ii��H2O��= 0.4/1��100% = 40%��
��a=2��b=1��������ʽ����֪��
H2O(g) + CO(g) ![]() CO2(g) + H2(g)
CO2(g) + H2(g)
��ʼn/mol 2 1 0 0
�仯n/mol 0.4 0.4 0.4 0.4
ƽ��n/mol 1.6 0.6 0.4 0.4
��c = 0.6��ʵ��iii����iii��CO��= 0.4/1��100% = 40%��
��4�������¶���ͬ��Ͷ�ϱ�Խ���൱������������Ũ�ȣ���ʹƽ�������ƶ���CO��ƽ��ת��������֮��CO��ƽ��ת����Խ��Ͷ�ϱ�Խ��ͼ��֪��������һ����̼��Ͷ���ȣ�a > b > c��Ͷ�ϱȱ��ֲ���ʱ�������¶ȣ�CO��ƽ��ת������С��ǰ�ߵ���ƽ�������ȷ����ƶ�������˵��ƽ�����淴Ӧ�����ƶ�������淴Ӧ�����ȷ�Ӧ�����淴Ӧ�������仯�෴��������Ӧ�Ƿ��ȷ�Ӧ����5�����������֪��ȼ�Ϻ�������O2��һ��Ӧ����CO2������ӦʽΪ![]() ��
��![]() ��������A��pH=13��֪���������KOH��Һ��Ũ��Ϊ0.1 mol/L����cV��֪2 L������Һ��KOHΪ0.2 mol�����ɵ��ת�Ƶ��ӹ�ϵʽ2KCl+2H2O
��������A��pH=13��֪���������KOH��Һ��Ũ��Ϊ0.1 mol/L����cV��֪2 L������Һ��KOHΪ0.2 mol�����ɵ��ת�Ƶ��ӹ�ϵʽ2KCl+2H2O![]() 2KOH+H2��+Cl2����2e����֪��ת�Ƶ���ҲΪ0.2mol��Ȼ���� CO + 2 O2����2 e�� = CO32����֪��ȼ�ϵ�������ĵ�COΪ0.1mol�������nM��֪��COΪ2.8g��
2KOH+H2��+Cl2����2e����֪��ת�Ƶ���ҲΪ0.2mol��Ȼ���� CO + 2 O2����2 e�� = CO32����֪��ȼ�ϵ�������ĵ�COΪ0.1mol�������nM��֪��COΪ2.8g��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���й��Ŵ��Ĵ���֮һ�ĺڻ�ҩ����������ǡ�ľ̿�ۺ���ʯ��ɣ�������������������ʮ���ձ飬��Ӱ�����ǽ�����ʳƷ��ȫ���������������䷽��̼�����ƣ�С�մͳ�����ɡ����й�����ʯ�ͳ��۵ijɷ������ȷ����
A.KNO3��NH4HCO3
B. KNO3��Na2CO3
C. HNO3��(NH4)2CO3
D.NH4NO3��Na2CO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ϩ�������MMA���Ǿۼ���ϩ��������л��������ĵ��壬Ҳ��������������֬�����ϡ�Ϳ�ϡ�ճ�ϼ������ȣ�MMA�ĺϳ�·����ͼ��ʾ����Ӧ�������Լ��ԣ���
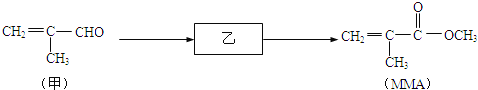
��ش�
��1�����������������ŵ������� ��
��2��MMA�ķ���ʽ�� ��
��3���ҵĽṹ��ʽ�� ��
��4��MMA��һ�����������ɾۼ���ϩ������Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ��Ʊ��빤ҵ�����������
��NH3 ![]() NO
NO ![]() HNO3
HNO3
��ŨHCl ![]() Cl2
Cl2 ![]() Ư��
Ư��
��MgCl2(aq) ![]() ��ˮMgCl2
��ˮMgCl2 ![]() Mg
Mg
������NaCl(aq) ![]() NaHCO3
NaHCO3 ![]() Na2CO3
Na2CO3
��������![]() NaAlO2��Һ
NaAlO2��Һ![]() Al(OH)3
Al(OH)3![]() Al2O3
Al2O3 ![]() Al
Al
A���٢ܢ� B���٢ۢ� C���ڢۢ� D���ڢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ع㷺Ӧ���ھ�ˮ����ع�ҵ������ҵ�����Ѱ������ĸ���ƷFeSO4�Ʊ�������ص������������£�

�����ϵ�֪K2FeO4��һЩ���ʣ�
���ڼ��Ի������ȶ��������Ժ����������²��ȶ���
����ˮ���ܽ�Ⱥܴ���������ˮ�Ҵ����л��ܼ���
�ش��������⣺
��1��д������I�У�����Fe3+�����ӷ�Ӧ����ʽ��
��2������II�У��Լ�AΪ ���H2O2����HNO3����NaC1O��������Ӧ�����ӷ���ʽΪ_____________________��
��3������I�а�����ȴ�ᾧ������ϴ�ӡ����X�����裬ϴ�Ӹ����Ŀ�����Ѽ���ˮ������ϴ�Ӳ���ʱӦ���� ϴ�ӡ�
��4����ˮʱ�������������ˮ��Ӧ������״��Fe��OH��3���벹�䲢��ƽ�÷�Ӧ����ʽ��ϵ�������
______K2FeO4 + H2O ![]() Fe��OH��3��������+ KOH + ��
Fe��OH��3��������+ KOH + ��
��һ������K2FeO4Ͷ��һ��Ũ�ȵ�FeC13��Һ�У����ʣ��K2FeO4Ũ������ͼ��ʾ���Ʋ��������I������II�����ԭ����: ��

��5���ƵõĴ�K2FeO4��Ʒ�г���������KCl��ȡ5.0 g�ֲ�Ʒ��������ϡ���ᣬ��ַ�Ӧ���������������������˵õ�������ϴ�ӡ���������õ�1.435 g���壬K2FeO4����������Ϊ___________���������õ������ԭ��������O 16 Cl 35.5 K 39 Fe 56 Ag 108��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����( )
A��Al2O3�����ͻ���ϡ�Al(OH)3������ȼ��
B��̼�ظֵ���Ҫ�ɷ�����̼�Ͻ�˾ĸ�춦����Ҫ�ɷ���ͭ���Ͻ�
C����Ȼ���в���������̬�Ĺ裬����Ҫ�Զ�����������ε���ʽ���� [
D��ͨ����ѧ�仯����ʵ��12C��14C����ת��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���27.5 gˮ���ܽ�12.5 g CuSO4��5H2O��ǡ�ôﵽ���ͣ�����Һ�ܶ�Ϊ1.21 g/cm3����
��1������Һ���������ӵ������ʵ��������������λ��Ч���֣���ͬ����
��2��ȡ��20.0 mL����Һ������ܶ�Ϊ1.00 mol/L��ϡ��Һ����ϡ�ͺ���Һ������Ƕ��ٺ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йؽ�������;���������õ��ǽ����Ļ�ѧ���ʵ���( )
A��ͭ�������� B�����������侵
C��������������Һ�е��� D���������������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com