
【题目】已知热化学方程式:
C(金刚石,s)+O2(g)===CO2(g) ΔH1
C(石墨,s)+O2(g)===CO2(g) ΔH2
C(石墨,s)===C(金刚石,s) ΔH3=+1.9 kJ·mol-1
下列说法正确的是( )
A.石墨转化成金刚石的反应是吸热反应
B.金刚石比石墨稳定
C.ΔH3=ΔH1-ΔH2
D.ΔH1>ΔH2
科目:高中化学 来源: 题型:
【题目】I、请根据如下图所示转化关系回答有关问题。A和B均为钠盐的水溶液,A呈中性,B呈碱性并具有强氧化性。
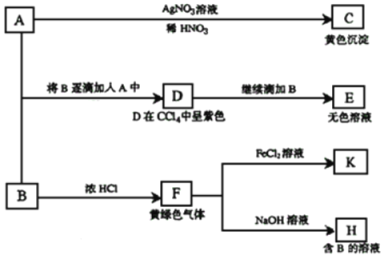
(1)写出A、B的化学式:A ,B 。
(2)依次写出A→D和D→E(E中含有某+5价元素的含氧酸根离子)的离子方程式: , 。
(3)写出将SO2气体通入K溶液中发生反应的离子方程式: 。
II、(1)将0.4gNaOH和1.06gNa2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。在如下图所示坐标系中画出能正确表示加入盐酸的体积和生成CO2的物质的量的关系图像。

(2)将18.4gNaOH和NaHCO3固体混合物,在密闭容器中加热到约250℃,经充分反应后排出气体,冷却,称得剩余固体质量为16.6g。试计算混合物中NaOH的质量分数。(请写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程没有发生化学反应的是( )
A、用活性炭去除冰箱中的异味
B、用热碱水清除炊具上残留的油污
C、用浸泡过高锰酸钾溶液的硅藻土保存水果
D、用含硅胶、铁粉的透气小袋与食品一起密封包装
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池的应用极为广泛。利用如下图所示原电池可测量空气中Cl2的含量,其中电解质是Ag+可以自由移动的固体物质,下列分析正确的是
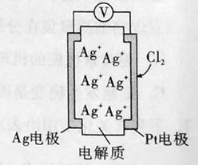
A.电流经外电路从Ag流向Pt电极
B.电池工作时,电解质中Ag+数目增多
C.正极反应:Cl2+2e-=2Cl-
D.空气中c(Cl2)越大,Ag极消耗速率越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、关于工业转化图(见下图):

1、①反应类型: ④反应类型: 。
2、实验室制备乙烯的反应条件是 ;反应温度过低会产生副产物: (写结构简式);
II、现拟分离混有乙醇、乙酸和水的乙酸乙酯粗产品,下图是分离操作步骤的流程图,试填写图中试剂的化学式及分离方法

(1)试剂b是 ;
(2)分离方法①是: ;分离方法②是: ;
(3)A是: ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是中学化学常见单质, X、Y、Z、M、N、W、H、K是常见化合物,X是B和C的化合产物,它们之间有如下转化关系(反应物和产物中的H2O已略去):
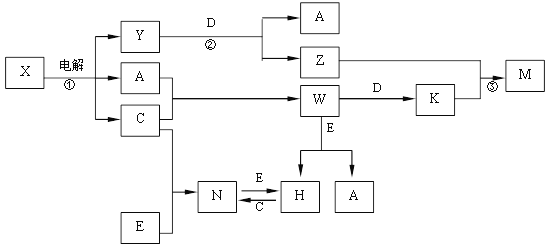
(1)Y的电子式为 ,构成E单质的元素在周期表中位于第 周期第 族
(2)反应①的离子方程式为
反应②的离子方程式为
反应③的离子方程式为
(3)某工厂用C制漂白粉。
①写出制漂白粉的化学方程式
②为测定该工厂制得的漂白粉中有效成分的含量,某小组进行了如下实验:称取漂白粉2.0g,研磨后溶解,配制成250mL溶液,取出25.00mL加入到锥形瓶中,再加入过量的KI溶液和过量的硫酸,此时发生的离子方程式为:
静置。待完全反应后,用0.1mol·L-1的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为:2Na2S2O3+I2=Na2S4O6+2NaI,共用去Na2S2O3溶液20.00mL。则该漂白粉中有效成分的质量分数为 (保留到小数点后两位)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com