
【题目】A、B、C、D、E是中学化学常见单质, X、Y、Z、M、N、W、H、K是常见化合物,X是B和C的化合产物,它们之间有如下转化关系(反应物和产物中的H2O已略去):
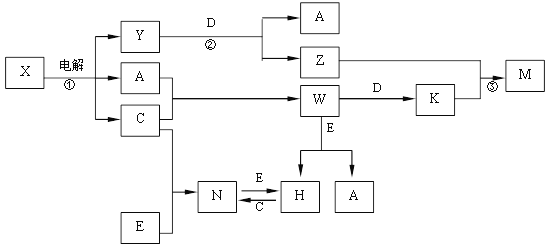
(1)Y的电子式为 ,构成E单质的元素在周期表中位于第 周期第 族
(2)反应①的离子方程式为
反应②的离子方程式为
反应③的离子方程式为
(3)某工厂用C制漂白粉。
①写出制漂白粉的化学方程式
②为测定该工厂制得的漂白粉中有效成分的含量,某小组进行了如下实验:称取漂白粉2.0g,研磨后溶解,配制成250mL溶液,取出25.00mL加入到锥形瓶中,再加入过量的KI溶液和过量的硫酸,此时发生的离子方程式为:
静置。待完全反应后,用0.1mol·L-1的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为:2Na2S2O3+I2=Na2S4O6+2NaI,共用去Na2S2O3溶液20.00mL。则该漂白粉中有效成分的质量分数为 (保留到小数点后两位)。
【答案】(1)![]() ,4,Ⅷ;
,4,Ⅷ;
(2) 2Cl-+2 H2O![]() 2OH-+Cl2↑+ H2↑;2Al+2OH-+2 H2O=2AlO2-+ 3H2↑;Al3++3AlO2-+6H2O = 4Al(OH)3↓;
2OH-+Cl2↑+ H2↑;2Al+2OH-+2 H2O=2AlO2-+ 3H2↑;Al3++3AlO2-+6H2O = 4Al(OH)3↓;
(3)①2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;②ClO-+2I-+2H+=I2+Cl-+H2O ,35.75% 。
【解析】试题分析:根据问题(3),推出C为氯气,因此是电解饱和食盐水,X为NaCl,A为氢气,Y为NaOH,D和NaOH产生H2,则D为Al,K为AlCl3,M为Al(OH)3,E和盐酸反应生成氢气,则E为金属,N是金属氯化物,E和Cl2反应,说明E是变价金属,即E为Fe,N为FeCl3,H为FeCl2,(1)NaOH属于离子化合物,其电子式为![]() ;(2)①根据上述推断,离子反应方程式为:2Cl-+2 H2O
;(2)①根据上述推断,离子反应方程式为:2Cl-+2 H2O![]() 2OH-+Cl2↑+ H2↑;反应②的离子反应方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑;反应③的离子反应方程式为:Al3++3AlO2-+6H2O=4Al(OH)3↓;(3)①制取漂白粉,用氯气和氢氧化钙的反应,即2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,②ClO-+2I-+2H+=I2+Cl-+H2O ,建立关系式ClO-~I2~2Na2S2O3,m(Ca(ClO)2)=20×10-3×0.1×250×143/(2×2×25)g=0.715g,则漂白粉的有效成分质量分数为0.715/2×100%=35.75%。
2OH-+Cl2↑+ H2↑;反应②的离子反应方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑;反应③的离子反应方程式为:Al3++3AlO2-+6H2O=4Al(OH)3↓;(3)①制取漂白粉,用氯气和氢氧化钙的反应,即2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,②ClO-+2I-+2H+=I2+Cl-+H2O ,建立关系式ClO-~I2~2Na2S2O3,m(Ca(ClO)2)=20×10-3×0.1×250×143/(2×2×25)g=0.715g,则漂白粉的有效成分质量分数为0.715/2×100%=35.75%。


科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体乙、丙及物质D、E、F、G、H,它们之间发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
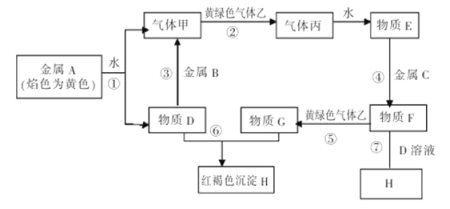
请根据以上信息回答下列问题:
(1)物质F的化学式为 。
(2)说出黄绿色气体乙的一种用途 。
(3)区别E、F两种溶液最简单的方法是 ,实验室检验G中所含的金属离子时,常在G的溶液中加入 溶液。
(4)反应①的离子方程式为 。
(5)物质F→H的转化需经过两个连续进行的反应,请写出这两个反应的化学方程式: 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:
C(金刚石,s)+O2(g)===CO2(g) ΔH1
C(石墨,s)+O2(g)===CO2(g) ΔH2
C(石墨,s)===C(金刚石,s) ΔH3=+1.9 kJ·mol-1
下列说法正确的是( )
A.石墨转化成金刚石的反应是吸热反应
B.金刚石比石墨稳定
C.ΔH3=ΔH1-ΔH2
D.ΔH1>ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态过氧化氢。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出257.7kJ的热量(相当于25℃、101 kPa下测得的热量)。反应的热化学方程式为 。又已知H2O(l)=H2O(g) ΔH=+44kJ/mol。则16g液态肼与过氧化氢反应生成液态水时放出的热量是 kJ。
(2)分别取40 mL 0.50 mol/L盐酸与 0.55 mol/L NaOH溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
假设盐酸和氢氧化钠溶液的密度都是1 g/cm3,又知中和后生成溶液的比热容c = 4.18 J/(g·℃)。实验时,还需测量的数据有 。
A.反应前盐酸溶液的温度
B.反应前盐酸溶液的质量
C.反应前氢氧化钠溶液的温度
D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度
F.反应后混合溶液的质量
某学生实验记录数据如下:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热为ΔH = ____________。
假定该学生的操作完全同上,实验中改用100 mL 0.50 mol/L盐酸跟100 mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa、25℃时,16 gN2H4在氧气中完全燃烧生成氮气,放出热量312 kJ。N2H4完全燃烧反应的热化学方程式是 。
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼—空气燃料电池放电时:正极的电极反应式是 。负极的电极反应方程式是 。
(3)下图是一个电化学过程示意图。

① 锌片上发生的电极反应方程式是 。
② 假设使用肼—空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼一空气燃料电池理论上消耗标准状况下的空气 L(假设空气中氧气体积含量为20%)
(4)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的离子方程式是 。
(5)将0.3 mol AgNO3、0.4 mol Cu(NO3)2和0.1mol KCl溶于水配成100 mL溶液,用惰性电极电解一段时间后,当阴极生成0.1mol气体时,此时,另一极上的气体体积(标准状况)为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )
A.为防止水污染,可用O3替代Cl2作饮用水消毒剂
B.实验室可用浓硫酸干燥SO2气体
C.含H2SO4的废水用BaCl2处理后不可直接排放
D.Al2(SO4)3,可除去碱性废水及酸性废水中的悬浮颗粒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粉煤灰是燃煤电厂的废渣,主要成分为SiO2、Al2O3、Fe2O3和C等。实验室模拟工业从粉煤灰提取活性Al2O3,其流程如下图:

已知烧结过程的产物主要是:NaAlO2、Ca2SiO4、NaFeO2和Na2SiO3等。
(1)写出烧结过程中铝元素转化的化学方程式 。
(2)操作a为冷却、研磨,其中研磨的目的是 。
(3)浸出过程中,NaFeO2可完全水解,水解反应的离子方程式为 。
(4)操作b的名称是 ,所用的玻璃仪器有 、 和烧杯。
(5)“碳化”时生成沉淀,沉淀的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萤石(氟化钙CaF2)晶体属于立方晶系,在氟化钙的晶胞中每个Ca2+被8个F﹣所包围,则每个F﹣周围最近距离的Ca2+数目为( )
A.2 B.4 C.6 D.8
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com