
【题目】萤石(氟化钙CaF2)晶体属于立方晶系,在氟化钙的晶胞中每个Ca2+被8个F﹣所包围,则每个F﹣周围最近距离的Ca2+数目为( )
A.2 B.4 C.6 D.8
 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是中学化学常见单质, X、Y、Z、M、N、W、H、K是常见化合物,X是B和C的化合产物,它们之间有如下转化关系(反应物和产物中的H2O已略去):
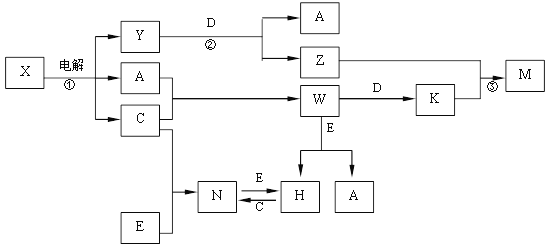
(1)Y的电子式为 ,构成E单质的元素在周期表中位于第 周期第 族
(2)反应①的离子方程式为
反应②的离子方程式为
反应③的离子方程式为
(3)某工厂用C制漂白粉。
①写出制漂白粉的化学方程式
②为测定该工厂制得的漂白粉中有效成分的含量,某小组进行了如下实验:称取漂白粉2.0g,研磨后溶解,配制成250mL溶液,取出25.00mL加入到锥形瓶中,再加入过量的KI溶液和过量的硫酸,此时发生的离子方程式为:
静置。待完全反应后,用0.1mol·L-1的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为:2Na2S2O3+I2=Na2S4O6+2NaI,共用去Na2S2O3溶液20.00mL。则该漂白粉中有效成分的质量分数为 (保留到小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年8月12日晚11时20分左右,天津港国际物流中心区域内瑞海公司所属危险品仓库发生的爆炸,造成了严重的人员伤亡,据瑞海国际官网信息,该公司仓储含有以下种类物质:压缩气体天然气、易燃液体乙酸乙酯、遇湿易燃物品电石、氰化钠、腐蚀品硫化碱等。
(1)由于电石、金属钠、金属钾等物质能够跟水反应给灾后救援工作带来了很多困难。
①如果在实验室,你处理金属钠着火的方法是 。(填序号)
A.泡沫灭火器 B.消防车喷水 C.沙土
②电石的主要成分为CaC2,遇水会产生可燃性气体,写出CaC2中所含的化学键类型____________
(2)硫化碱其实就是我们常见的硫化钠,触及皮肤和毛发时会造成灼伤。①其水溶液呈强碱性,故俗称硫化碱。 ②其水溶液在空气中会缓慢地氧化成Na2S2O3,该反应中还原剂与氧化剂物质的量之比为 。
(3)事故发生后,爆炸中心区、爆炸区居民楼周边以及海河等处都受到了严重的氰化物污染。处理NaCN的方法有多种。
方法一:用NaClO在碱性条件下跟NaCN反应生成无毒害的物质,试写出该反应的离子反应方程式 。
方法二:用氯气处理CN-是选修一上介绍的一种方法,可谓以毒攻毒,请写出碱性条件下用氯气氧化CN-生成可溶性碳酸盐和一种空气中主要气体的离子反应方程式______________________。
方法三:这些泄露的氰化钠将通过喷洒双氧水的方式来处理,用双氧水处理后会释放氨气同时生成无毒的碳酸氢钠,以减轻污染。写出离子反应方程式______________________ 。
(4)环保部门为测定H2O2溶液浓度,方法如下:用移液管吸取10.00mL的H2O2样品盛入l00ml容量瓶中,加水稀释至刻度线,取25.00mL溶液盛入锥形瓶里,再加入l0mL 3mol/L稀硫酸(过量),用0.02mol/L的标准浓度的KMnO4溶液滴定,所用体积为20.00ml,滴定至终点时,溶液颜色的变化_____________;原H2O2溶液的浓度为 mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于判断过程的方向的说法正确的是
A.所有自发进行的化学反应都是放热反应
B.同一物质的固、液、气三种状态的熵值相同
C.石墨比金刚石稳定,故石墨转化为金刚石的反应可以自发进行
D.由能量判据和熵判据组合而成的复合判据,将更适合于所有的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在酸性溶液中能大量共存的是
A、Na+、Fe2+、NO3-、SCN— B、Ca2+、K+、Cl—、NO3—
C、Al3+、K+、OH—、NO3— D、Na+、Ca2+、SiO32—、Cl—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上生产高氯酸时,还同时生产了一种常见的重要含氯消毒剂和漂白剂亚氯酸钠(NaClO2),其工艺流程如下:
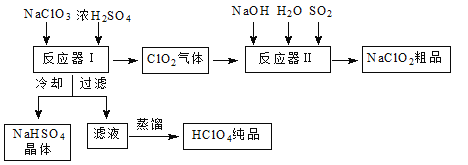
已知:①NaHSO4溶解度随温度的升高而增大,适当条件下可结晶析出。
②高氯酸是至今为止人们已知酸中的最强酸,沸点90 ℃。
请回答下列问题:
(1)反应器Ⅰ中发生反应的化学方程式为 ,冷却的目的是 ,能用蒸馏法分离出高氯酸的原因是___________________。
(2)反应器Ⅱ中发生反应的离子方程式为__________________。
(3)通入反应器Ⅱ中的SO2用H2O2代替同样能生成NaClO2,请简要说明双氧水在反应中能代替SO2的原因是_________________________。
(4)Ca(ClO)2、ClO2、NaClO2等含氯化合物都是常用的消毒剂和漂白剂,是因为它们都具有________________,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的浓硫酸跟过量的锌充分反应,产生的气体可能有
① SO2 ② SO3 ③ H2S ④ H2
A.①②③ B.①③④ C.①②④ D.只有①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于氧化还原反应,又是吸热反应的是
A. 锌粒与稀硫酸的反应
B. 甲烷在空气中燃烧的反应
C. 灼热的木炭与CO2的反应
D. Ba(OH)28H2O晶体与NH4Cl晶体的反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com