
【题目】2015年8月12日晚11时20分左右,天津港国际物流中心区域内瑞海公司所属危险品仓库发生的爆炸,造成了严重的人员伤亡,据瑞海国际官网信息,该公司仓储含有以下种类物质:压缩气体天然气、易燃液体乙酸乙酯、遇湿易燃物品电石、氰化钠、腐蚀品硫化碱等。
(1)由于电石、金属钠、金属钾等物质能够跟水反应给灾后救援工作带来了很多困难。
①如果在实验室,你处理金属钠着火的方法是 。(填序号)
A.泡沫灭火器 B.消防车喷水 C.沙土
②电石的主要成分为CaC2,遇水会产生可燃性气体,写出CaC2中所含的化学键类型____________
(2)硫化碱其实就是我们常见的硫化钠,触及皮肤和毛发时会造成灼伤。①其水溶液呈强碱性,故俗称硫化碱。 ②其水溶液在空气中会缓慢地氧化成Na2S2O3,该反应中还原剂与氧化剂物质的量之比为 。
(3)事故发生后,爆炸中心区、爆炸区居民楼周边以及海河等处都受到了严重的氰化物污染。处理NaCN的方法有多种。
方法一:用NaClO在碱性条件下跟NaCN反应生成无毒害的物质,试写出该反应的离子反应方程式 。
方法二:用氯气处理CN-是选修一上介绍的一种方法,可谓以毒攻毒,请写出碱性条件下用氯气氧化CN-生成可溶性碳酸盐和一种空气中主要气体的离子反应方程式______________________。
方法三:这些泄露的氰化钠将通过喷洒双氧水的方式来处理,用双氧水处理后会释放氨气同时生成无毒的碳酸氢钠,以减轻污染。写出离子反应方程式______________________ 。
(4)环保部门为测定H2O2溶液浓度,方法如下:用移液管吸取10.00mL的H2O2样品盛入l00ml容量瓶中,加水稀释至刻度线,取25.00mL溶液盛入锥形瓶里,再加入l0mL 3mol/L稀硫酸(过量),用0.02mol/L的标准浓度的KMnO4溶液滴定,所用体积为20.00ml,滴定至终点时,溶液颜色的变化_____________;原H2O2溶液的浓度为 mol/L。
【答案】(1)①C;②离子键和共价键
(2)1:1
(3)2OH-+5ClO-+2CN-==5Cl-+N2+2CO32-+H2O;
5Cl2+2CN-+12OH-==2CO32-+N2+10Cl-+6H2O;CN-+H2O+H2O2==NH3+HCO3-
(4)溶液由无色变为浅红色或红色,且半分钟不变色;0.4
【解析】
试题分析:(1)①金属钠着火时,与空气中的氧气反应生成过氧化钠,过氧化钠与水、二氧化碳反应,而干冰灭火器和泡沫灭火器都生成二氧化碳,只能用干燥沙土盖灭,故答案为:C;②CaC2属于离子化合物,含有离子键,碳原子间存在共价键,故答案为:离子键和共价键;
(2)反应2Na2S+2O2+H2O=Na2S2O3+2NaOH中O2中O化合价降低,所以其为氧化剂,Na2S中S元素的化合价升高,为还原剂,根据得失电子守恒,该反应中氧化剂与还原剂的物质的量之比为1:1,故答案为:1:1;
(3)方法一:NaClO在碱性条件下跟NaCN反应生成氮气,反应的离子反应方程式:2OH-+2CN-+5ClO-=2CO32-+5Cl-+H2O+N2↑;双氧水将废水中的CN-氧化成无毒的物质,得到CN-被氧化后的产物为HCO3-(或CO32-)、N2,故答案为:2OH-+2CN-+5ClO-=2CO32-+5Cl-+H2O+N2↑;HCO3-;
方法二:碱性条件下用氯气氧化CN-生成可溶性碳酸盐和一种空气中主要气体,气体为氮气,则该反应的离子反应方程式为:5Cl2+12OH-+2CN-=10Cl-+2CO32-+6H2O+N2↑,故答案为:5Cl2+12OH-+2CN-=10Cl-+2CO32-+6H2O+N2↑;
方法三:用过氧化氢处理NaCN可生成可溶性碳酸盐和氨,碳酸盐为碳酸钠,CN-只能存在与碱性溶液,则该溶液一定为碱性溶液,所以该反应的离子方程式为:H2O2+CN-+OH-=CO32-+NH3,故答案为:H2O2+CN-+OH-=CO32-+NH3;
(4)高锰酸钾呈现紫色,滴定终点时,溶液由无色变为浅红色或红色,且半分钟不变色。
设稀释后H2O2溶液的浓度为x.
2KMnO4+5H2O2+3H2SO4═2MnSO4+K2SO4+5O2↑+8H2O
2 5
0.02L×0.02mol/L 0.025L×x
![]() =
=![]() ,x=0.04mol/L,原H2O2溶液的浓度为0.4mol/L,故答案为:溶液由无色变为浅红色或红色,且半分钟不变色;0.4。
,x=0.04mol/L,原H2O2溶液的浓度为0.4mol/L,故答案为:溶液由无色变为浅红色或红色,且半分钟不变色;0.4。


科目:高中化学 来源: 题型:
【题目】(1)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态过氧化氢。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出257.7kJ的热量(相当于25℃、101 kPa下测得的热量)。反应的热化学方程式为 。又已知H2O(l)=H2O(g) ΔH=+44kJ/mol。则16g液态肼与过氧化氢反应生成液态水时放出的热量是 kJ。
(2)分别取40 mL 0.50 mol/L盐酸与 0.55 mol/L NaOH溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
假设盐酸和氢氧化钠溶液的密度都是1 g/cm3,又知中和后生成溶液的比热容c = 4.18 J/(g·℃)。实验时,还需测量的数据有 。
A.反应前盐酸溶液的温度
B.反应前盐酸溶液的质量
C.反应前氢氧化钠溶液的温度
D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度
F.反应后混合溶液的质量
某学生实验记录数据如下:
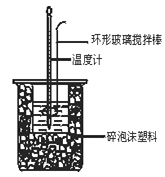
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热为ΔH = ____________。
假定该学生的操作完全同上,实验中改用100 mL 0.50 mol/L盐酸跟100 mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-。某同学收集了该地区的雾霾,经必要的预处理后得试样溶液,设计并完成了如下的实验:

已知:3NO3-+ 8Al + 5OH-+ 18H2O = 3NH3+ 8[Al(OH)4]-
根据以上的实验操作与现象,该同学得出的结论不正确的是( )
A. 试样中一定不含Al3+
B. 试样中肯定存在NH4+、Mg2+、SO42-和NO3-
C. 试样中可能存在Na+、Cl-
D. 该雾霾中可能存在NaNO3、NH4Cl和MgSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水溶液中能大量共存的一组离子是( )
A.Pb2+、Hg2+、S2-、SO42- B.Na+、Ba2+、Cl-、NO3-
C.H+、Na+、Fe2+、MnO4- D.ClO-、Al3+、Br-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以下几种有机物:
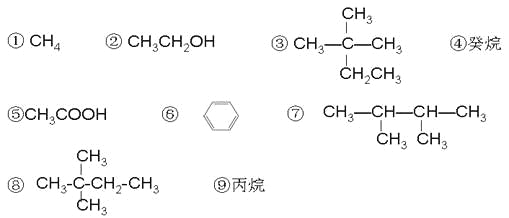
请利用上述给出的物质按要求回答下列问题:
(1)相对分子质量为44的烷烃的结构简式为 ;
(2)分子中含有14个氢原子的烷烃的分子式是 ;
(3)与③互为同分异构体的是 (填序号);
(4)具有特殊气味,常作萃取剂的有机物在铁作催化剂的条件下与液溴发生一取代反应的化学方程式 ;
(5)用“>”表示①③④⑨熔沸点高低顺序: (填序号);
(6)有机物②在加热条件下和CuO反应的化学方程式 ;
(7)在120℃,1.01×105Pa条件下,某种气态烃与足量的O2完全反应后,测得反应前后气体的体积没有发生改变,则该烃是 (填序号);它与⑧互为 关系;
(8)有机物⑤和②在一定条件下发生反应的化学方程式是 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萤石(氟化钙CaF2)晶体属于立方晶系,在氟化钙的晶胞中每个Ca2+被8个F﹣所包围,则每个F﹣周围最近距离的Ca2+数目为( )
A.2 B.4 C.6 D.8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列实验操作或对实验事实的描述不正确的是________(填序号)。
A.不宜用瓷坩埚灼烧氢氧化钠或碳酸钠
B.使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏大
C.分液操作时,由于分液漏斗下端已沾满下层液体,故上层液体要从上口倒出
D.用托盘天平称量11.74 g氯化钠晶体
E.用结晶法分离硝酸钾和氯化钠的混合物
(2)实验室需要0.1 mol·L-1 NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
①如图所示的仪器中配制溶液肯定不需要的是____________(填序号);配制上述溶液还需用到的玻璃仪器是________________(填仪器名称)。

②下列操作中,容量瓶所不具备的功能有____________(填序号)。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
③请计算需用托盘天平称取固体NaOH的质量为____________g。某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图。由图中可以看出,烧杯的实际质量为____________g。

④根据计算得知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为________mL(计算结果保留一位小数)。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com