
【题目】(1)下列实验操作或对实验事实的描述不正确的是________(填序号)。
A.不宜用瓷坩埚灼烧氢氧化钠或碳酸钠
B.使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏大
C.分液操作时,由于分液漏斗下端已沾满下层液体,故上层液体要从上口倒出
D.用托盘天平称量11.74 g氯化钠晶体
E.用结晶法分离硝酸钾和氯化钠的混合物
(2)实验室需要0.1 mol·L-1 NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
①如图所示的仪器中配制溶液肯定不需要的是____________(填序号);配制上述溶液还需用到的玻璃仪器是________________(填仪器名称)。

②下列操作中,容量瓶所不具备的功能有____________(填序号)。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
③请计算需用托盘天平称取固体NaOH的质量为____________g。某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图。由图中可以看出,烧杯的实际质量为____________g。

④根据计算得知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为________mL(计算结果保留一位小数)。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是____________________。
【答案】(1)D(2)①AC 烧杯、玻璃棒②BCE③2.0 27.4④13.6 将浓硫酸沿烧杯内壁缓缓注入水中,并用玻璃棒不断搅拌
【解析】
试题分析:(1)瓷坩埚中含有二氧化硅,再高温下能和强碱或碳酸钠反应,A正确;使用容量瓶配制溶液时,俯视刻度线定容后所得溶液的体积偏小,浓度偏大,B正确;分液操作时,由于分液漏斗下端已沾满下层液体,故上层液体要从上口倒出,C正确;托盘天平只能读数到0.1g,D不正确;硝酸钾和氯化钠的溶解度受温度的影响程度不同,所以可以用结晶法分离,E正确。
(2)①配制溶液不需要烧瓶和分液漏斗;配制上述溶液还需用到的玻璃仪器是烧杯、玻璃棒;②容量瓶只能配制溶液,而不能作为反应容器,也不能长时间保存溶液或在其中溶解固体。没有450 mL的容量瓶,故需要配制500 mL的NaOH溶液,m=cvM=0.5L×0.1 mol·L-1×40g/mol=2.0g;游码是2.6g,但砝码和物体的位置放倒了,所以实际质量应该是30.0g-2.6g=27.4g;④0.5 mol·L-1硫酸溶液500 mL中硫酸的质量是0.5L×0.5mol/L×98g/mol=24.5g,所以所需质量分数为98%、密度为I.84 g·cm-3的浓硫酸的体积为![]() 。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是将浓硫酸沿烧杯内壁缓缓注入水中,并用玻璃棒不断搅拌。
。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是将浓硫酸沿烧杯内壁缓缓注入水中,并用玻璃棒不断搅拌。


科目:高中化学 来源: 题型:
【题目】2015年8月12日晚11时20分左右,天津港国际物流中心区域内瑞海公司所属危险品仓库发生的爆炸,造成了严重的人员伤亡,据瑞海国际官网信息,该公司仓储含有以下种类物质:压缩气体天然气、易燃液体乙酸乙酯、遇湿易燃物品电石、氰化钠、腐蚀品硫化碱等。
(1)由于电石、金属钠、金属钾等物质能够跟水反应给灾后救援工作带来了很多困难。
①如果在实验室,你处理金属钠着火的方法是 。(填序号)
A.泡沫灭火器 B.消防车喷水 C.沙土
②电石的主要成分为CaC2,遇水会产生可燃性气体,写出CaC2中所含的化学键类型____________
(2)硫化碱其实就是我们常见的硫化钠,触及皮肤和毛发时会造成灼伤。①其水溶液呈强碱性,故俗称硫化碱。 ②其水溶液在空气中会缓慢地氧化成Na2S2O3,该反应中还原剂与氧化剂物质的量之比为 。
(3)事故发生后,爆炸中心区、爆炸区居民楼周边以及海河等处都受到了严重的氰化物污染。处理NaCN的方法有多种。
方法一:用NaClO在碱性条件下跟NaCN反应生成无毒害的物质,试写出该反应的离子反应方程式 。
方法二:用氯气处理CN-是选修一上介绍的一种方法,可谓以毒攻毒,请写出碱性条件下用氯气氧化CN-生成可溶性碳酸盐和一种空气中主要气体的离子反应方程式______________________。
方法三:这些泄露的氰化钠将通过喷洒双氧水的方式来处理,用双氧水处理后会释放氨气同时生成无毒的碳酸氢钠,以减轻污染。写出离子反应方程式______________________ 。
(4)环保部门为测定H2O2溶液浓度,方法如下:用移液管吸取10.00mL的H2O2样品盛入l00ml容量瓶中,加水稀释至刻度线,取25.00mL溶液盛入锥形瓶里,再加入l0mL 3mol/L稀硫酸(过量),用0.02mol/L的标准浓度的KMnO4溶液滴定,所用体积为20.00ml,滴定至终点时,溶液颜色的变化_____________;原H2O2溶液的浓度为 mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的浓硫酸跟过量的锌充分反应,产生的气体可能有
① SO2 ② SO3 ③ H2S ④ H2
A.①②③ B.①③④ C.①②④ D.只有①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见物质A、B、C、D、E、X,存在下图转化关系 (部分生成物和反应条件略去)。下列推断不正确的是( )
![]()
A.若D是一种强碱,则A、B、C均可与X反应生成D
B.若D为NaCl,且A可与C反应生成B,则E可能是CO2
C.若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁
D.若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学键的叙述正确的是
A. 所有化学物质内部都存在化学键
B. 共价键存在于原子之间,也存在于分子之间
C. 离子键是阴、阳离子之间的相互吸引力
D. 化学键通常指的是相邻的两个或多个原子间的强烈的相互作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是一种重要的化工原料,可进行如下转化,其中C是食醋的主要成分。(部分反应物、生成物和反应条件已略去)
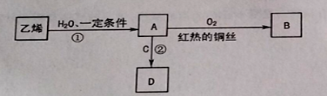
请回答下列问题。
(1)反应①的化学方程式是____________________________。
(2)B的结构简式是______________ ,C中官能团的名称是______________。
(3)反应②的化学方程式是_____________,反应类型是______________,反应后可用______________除去D中混有的C。
(4)鉴别乙烯和甲烷的方法是______________,若观察到______________,则证明气体是乙烯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于氧化还原反应,又是吸热反应的是
A. 锌粒与稀硫酸的反应
B. 甲烷在空气中燃烧的反应
C. 灼热的木炭与CO2的反应
D. Ba(OH)28H2O晶体与NH4Cl晶体的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋具有十分巨大的开发潜力,人民可以从海水中获得多种物质。
(1)不需经过化学变化就能从海水中获得的一种物质是________________________
(2)经上述操作后剩余的浓缩海水中含有大量的Mg2+,从中提取金属镁的流程如下:

①贝壳的主要成分是CaCO3,燃烧贝壳时发生反应的化学方程式是____________________________;在沉淀中生成的Mg(OH)2的离子方程式是________________________。
②过滤后向Mg(OH)2中加入________________即得到MgCl2溶液,在经过一系列操作得到MgCl2。
③电解熔融MgCl2得到镁蒸气,同时生成___________ ________________,它可用于上述流程中的_____________________________步骤,这样做的好处是__________________________,镁蒸气冷却后即为固体镁,冷却镁蒸气时可在下列哪种气体氛围中进行__________(填序号)
A.H2 B.O2 C.空气
④上述与含镁物质有关的操作中,消耗能量最多的步骤是_____________,原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.标准状况下,等体积的CH4和CO2所含的共用电子对数相等
B.与NaOH溶液、H2SO4溶液反应产生等量的H2,所需铝粉的质量相等
C.明矾溶液中K +和A13+的物质的量浓度相等
D.1molOH-和17gNH3所含的电子数相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com