
【题目】乙烯是一种重要的化工原料,可进行如下转化,其中C是食醋的主要成分。(部分反应物、生成物和反应条件已略去)
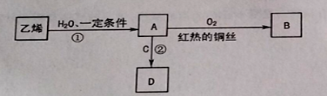
请回答下列问题。
(1)反应①的化学方程式是____________________________。
(2)B的结构简式是______________ ,C中官能团的名称是______________。
(3)反应②的化学方程式是_____________,反应类型是______________,反应后可用______________除去D中混有的C。
(4)鉴别乙烯和甲烷的方法是______________,若观察到______________,则证明气体是乙烯。
【答案】(1)CH2=CH2+H2O![]() C2H5OH
C2H5OH
(2)CH3CHO 羧基
(3)CH3COOH+C2H5OH![]() CH3COOC2H5+H2O 酯化反应 饱和Na2CO3溶液
CH3COOC2H5+H2O 酯化反应 饱和Na2CO3溶液
(4)将气体分别通入酸性高锰酸钾溶液中 酸性高猛酸钾溶液褪色
【解析】
试题分析:(1)乙烯与水在一定条件下发生加成反应生成乙醇,化学方程式为CH2=CH2+H2O![]() C2H5OH。
C2H5OH。
(2)乙醇在铜作催化剂加热的条件下与氧气反应生成乙醛,乙醛的结构简式是CH3CHO;食醋的主要成分是乙酸,乙酸的官能团为羧基。
(3)乙酸与乙醇在浓硫酸作催化剂的条件下发生酯化反应生成乙酸乙酯,反应的化学方程式为CH3COOH +C2H5OH ![]() CH3COOC2H5+H2O;乙酸与碳酸钠溶液反应,而乙酸乙酯不反应,则乙酸乙酯中混有乙酸可用饱和碳酸钠溶液除去。
CH3COOC2H5+H2O;乙酸与碳酸钠溶液反应,而乙酸乙酯不反应,则乙酸乙酯中混有乙酸可用饱和碳酸钠溶液除去。
(4)乙烯能与酸性高猛酸钾溶液反应,而乙烷不能,所以鉴别乙烯和甲烷的方法是将气体分别通入酸性高锰酸钾溶液中,若观察到酸性高猛酸钾溶液褪色,则证明气体是乙烯。


科目:高中化学 来源: 题型:
【题目】现有以下几种有机物:
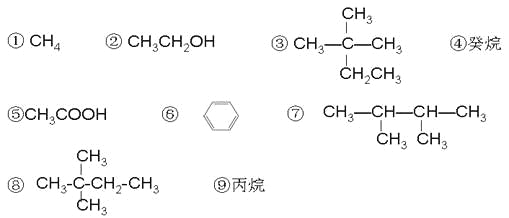
请利用上述给出的物质按要求回答下列问题:
(1)相对分子质量为44的烷烃的结构简式为 ;
(2)分子中含有14个氢原子的烷烃的分子式是 ;
(3)与③互为同分异构体的是 (填序号);
(4)具有特殊气味,常作萃取剂的有机物在铁作催化剂的条件下与液溴发生一取代反应的化学方程式 ;
(5)用“>”表示①③④⑨熔沸点高低顺序: (填序号);
(6)有机物②在加热条件下和CuO反应的化学方程式 ;
(7)在120℃,1.01×105Pa条件下,某种气态烃与足量的O2完全反应后,测得反应前后气体的体积没有发生改变,则该烃是 (填序号);它与⑧互为 关系;
(8)有机物⑤和②在一定条件下发生反应的化学方程式是 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙烯能发生以下转化:

(1)乙烯的结构式为: 。
(2)B中官能团的电子式: ;D中官能团的名称: 。
(3)写出反应的化学方程式及反应类型:
② ;反应类型: ;
③ ;反应类型: ;
④ ;反应类型: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列实验操作或对实验事实的描述不正确的是________(填序号)。
A.不宜用瓷坩埚灼烧氢氧化钠或碳酸钠
B.使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏大
C.分液操作时,由于分液漏斗下端已沾满下层液体,故上层液体要从上口倒出
D.用托盘天平称量11.74 g氯化钠晶体
E.用结晶法分离硝酸钾和氯化钠的混合物
(2)实验室需要0.1 mol·L-1 NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
①如图所示的仪器中配制溶液肯定不需要的是____________(填序号);配制上述溶液还需用到的玻璃仪器是________________(填仪器名称)。

②下列操作中,容量瓶所不具备的功能有____________(填序号)。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
③请计算需用托盘天平称取固体NaOH的质量为____________g。某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图。由图中可以看出,烧杯的实际质量为____________g。

④根据计算得知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为________mL(计算结果保留一位小数)。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于某溶液中所含离子的鉴别,下列判断正确的是
A.加入BaCl2溶液,生成白色沉淀,加稀硝酸沉淀不消失,则原溶液中一定含有SO42-
B.加入NaOH溶液,生成的白色沉淀在空气中迅速变为灰绿色,最终变为红褐色,则原溶液中一定含有Fe2+。
C.用洁净的铂丝蘸取溶液在火焰上灼烧,产生黄色的火焰,则原溶液中一定不含有K+
D.加盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定含有CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在日常生活中,为了达到更好的清洁效果,经常有人会将洁厕液(含有盐酸)与84消毒液混合使用,从而会发生引发中毒的事故。
(1)两种日化产品主要成分中都含有氯元素,该元素在元素周期表中位置是 。
(2)84消毒液的主要成分是次氯酸钠,写出次氯酸钠的电子式: 。
(3)常温下,0.1mol/L的NaClO溶液的PH=9.7,原因 。常温下HClO的电离平衡常数为 。洁厕液与84消毒液混合后会生成有毒的氯气。写出该反应的离子方程式 。
(4)高铁酸钾是一种高效多功能水处理剂,工业上常采用NaClO氧化法生产,反应原理为:
①在碱性条件下,利用NaClO氧化硝酸铁,制得Na2FeO4,该反应的离子反应方程式为 。
②Na2FeO4与KOH反应生成K2FeO4:Na2FeO4+2KOH=K2FeO4+2NaOH;K2FeO4在水溶液中易水解:4FeO42-+10H2O![]() 4Fe(OH)3+8OH-+3O2,在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 溶液(填序号)
4Fe(OH)3+8OH-+3O2,在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 溶液(填序号)
a.水 b.NH4Cl、异丙醇 c.Fe(NO3)3、异丙醇 d.CH3COONa、异丙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3 → Cu(NO3)2+NO↑+NO2↑+H2O (方程式未配平,不考虑 2NO2 ![]() N2O4)。
N2O4)。
(1)硝酸在该反应中体现的性质有_________________ _。
(2)如果参加反应的Cu和HNO3的物质的量之比是3:10,写出并配平该反应的离子方程式
_________ 。
(3)0.004molCu被硝酸完全溶解后,Cu失去的电子数是____________,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是____________,在标准状况下若将收集NO和NO2的集气瓶倒立于水中,通入一定量的氧气充分反应后发现无气体剩余,则通入O2的体积为________ mL;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com