
【题目】铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3 → Cu(NO3)2+NO↑+NO2↑+H2O (方程式未配平,不考虑 2NO2 ![]() N2O4)。
N2O4)。
(1)硝酸在该反应中体现的性质有_________________ _。
(2)如果参加反应的Cu和HNO3的物质的量之比是3:10,写出并配平该反应的离子方程式
_________ 。
(3)0.004molCu被硝酸完全溶解后,Cu失去的电子数是____________,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是____________,在标准状况下若将收集NO和NO2的集气瓶倒立于水中,通入一定量的氧气充分反应后发现无气体剩余,则通入O2的体积为________ mL;
【答案】(1)氧化性、酸性(2分)
(2)3Cu + 10H++ 4NO3-= 3Cu2++NO↑+3NO2↑+5H2O(2分)
(3)0.008NA(2分);0.012mol(2分) ;44.8mL(2分) ;
【解析】
试题分析:(1)硝酸和铜的反应中硝酸表现氧化性、酸性。(2)同和额硝酸的比例为3:10,则3摩尔铜失去6摩尔电子,则生成3摩尔硝酸铜,只有4摩尔硝酸表现氧化性,则一氧化氮和二氧化氮的物质的量分别为xmol,ymol,则有x+y=4 3x+y=6,则解x=1,y=3,即一氧化氮的系数为1,二氧化氮的系数为3,根据原子和电荷守恒配平方程式为:3Cu + 10H++ 4NO3-= 3Cu2++NO↑+3NO2↑+5H2O。(3)0.004摩尔铜失去0.008NA电子;若一氧化氮和二氧化氮的物质的量相等,则为xmol,则有3x+x=0.008,x=0.002,铜离子结合的硝酸的物质的量为0.008摩尔,则消耗的硝酸的总物质的量为0.008+0.002+0.002=0.0.012mol ;根据方程式计算,4NO+3O2+2H2O=4HNO3 4NO2+O2+2H2O=4HNO3,0.002摩尔一氧化氮消耗氧气的物质的量为0.0015摩尔,二氧化氮消耗的氧气的物质的量为0.0005摩尔,则氧气总物质的量为0.0015+0.0005=0.002摩尔,标况下体积为0.002×22.4=44.8mL。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】贵州凤岗的“富锌富硒”茶已享誉全国,因富含硒元素,有延年益寿、抗衰老等作用。但研究表明单质硒可能成为环境污染物,通过与浓盐酸、浓H2SO4反应可回收Se。在回收过程中涉及到如下两个化学反应:①SeO2+4KI+4HCl=Se+2I2+4KCl+2H2O;②Se+2H2SO4(浓)=2SO2![]() + SeO2+2H2O。下列叙述正确的是( )
+ SeO2+2H2O。下列叙述正确的是( )
A. 反应①中Se是氧化产物,I2是还原产物
B. 反应②中浓H2SO4是氧化剂,SeO2是还原产物
C. 反应①中每有1.0mol I2生成,转移电子数目为4 NA
D. SeO2、H2SO4(浓)、I2的氧化性由强到弱的顺序是H2SO4(浓)> SeO2> I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是一种重要的化工原料,可进行如下转化,其中C是食醋的主要成分。(部分反应物、生成物和反应条件已略去)
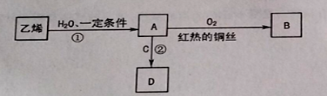
请回答下列问题。
(1)反应①的化学方程式是____________________________。
(2)B的结构简式是______________ ,C中官能团的名称是______________。
(3)反应②的化学方程式是_____________,反应类型是______________,反应后可用______________除去D中混有的C。
(4)鉴别乙烯和甲烷的方法是______________,若观察到______________,则证明气体是乙烯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝元素在地壳中的含量居第三位,金属铝在生成、生活中有广泛用途。
(1)铝在元素周期表中的位置是第____________周期、第____________族
(2)研究表明,铝元素有多种核素,只有27Al是稳定的,其中子数是____________
(3)工业冶炼金属铝的化学方程式是____________,反应中每生成1mol铝,转移电子 mol。
(4)高速铁路极大地方便了人们的出行。高速铁路的无缝钢轨焊接方法之一是利用铝粉与氧化铁反应,其化学方程式是___________________,利用该反应能将钢轨焊接在一起的原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋具有十分巨大的开发潜力,人民可以从海水中获得多种物质。
(1)不需经过化学变化就能从海水中获得的一种物质是________________________
(2)经上述操作后剩余的浓缩海水中含有大量的Mg2+,从中提取金属镁的流程如下:

①贝壳的主要成分是CaCO3,燃烧贝壳时发生反应的化学方程式是____________________________;在沉淀中生成的Mg(OH)2的离子方程式是________________________。
②过滤后向Mg(OH)2中加入________________即得到MgCl2溶液,在经过一系列操作得到MgCl2。
③电解熔融MgCl2得到镁蒸气,同时生成___________ ________________,它可用于上述流程中的_____________________________步骤,这样做的好处是__________________________,镁蒸气冷却后即为固体镁,冷却镁蒸气时可在下列哪种气体氛围中进行__________(填序号)
A.H2 B.O2 C.空气
④上述与含镁物质有关的操作中,消耗能量最多的步骤是_____________,原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.二氧化硫的排放会造成温室效应
B.绿色食品是不含任何化学物质的食品
C.利用丁达尔效应可区分溶液与胶体
D.用加热的方法不能鉴别NaHCO3和Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰的单质及其化合物在生产、生活中有广泛应用。
(1)碱性锌锰电池广泛应用于日常生活。电池的总反应式为:Zn(s)+2MnO2(s)+2H2O(l)===Zn(OH)2(s)+2MnOOH(s)。该电池的正极反应式为 。
(2)某学习小组拟以废旧干电池为原料制取锰,简易流程如下:
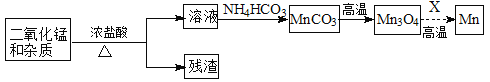
①加入浓盐酸溶解废旧电池内黑色物质过程中保持通风,其原因是 。
②从产品纯度、环保等角度考虑,X宜选择 (填代号)。
A.焦炭 B.铝 C.氢气 D.一氧化碳
③写出碳酸锰在空气中灼烧生成四氧化三锰的化学方程式 。
(3)电解硫酸锰溶液法制锰又叫湿法冶锰。以菱锰矿(主要成份是MnCO3,主要杂质是Fe2+、Co2+、Ni2+)为原料制备锰的工艺流程如下:
![]()
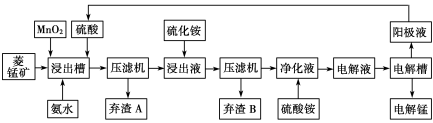
已知:NiS 、CoS均难溶于水。部分氢氧化物的pH如下表:(若某离子浓度小于等于105mol·L1,则认为完全沉淀)
物质 | Fe(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 | Fe(OH)3 |
开始沉淀pH | 7.5 | 7.7 | 7.6 | 8.3 | 2.7 |
完全沉淀pH | 9.7 | 8.4 | 8.5 | 9.8 | 3.8 |
①浸出槽内MnO2的作用是(用离子方程式表示) 。
②加入氨水调节浸出槽中溶液的pH范围为 。
③电解槽阴极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、环境密切相关,下列有关说法错误的是
A.水玻璃可用于制备硅胶和木材防火剂
B.用浸泡过高锰酸钾溶液的硅藻土保鲜水果
C.煤的气化是物理变化,是高效、清洁地利用煤的重要途径
D.侯氏制碱法的工艺过程中应用了物质溶解度的差异
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
物质 | 杂质 | 试剂 | 主要操作 | |
A | NaHCO3 | Na2CO3 | 盐酸 | 加热 |
B | SiO2 | Fe2O3 | 盐酸 | 过滤 |
C | I2 | H2O | 乙醇 | 萃取 |
D | H2O | Fe3+ | NaOH | 过滤 |
A.A、 B.B、 C.C、 D.D、
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com