
【题目】现有金属单质A、B、C和气体乙、丙及物质D、E、F、G、H,它们之间发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
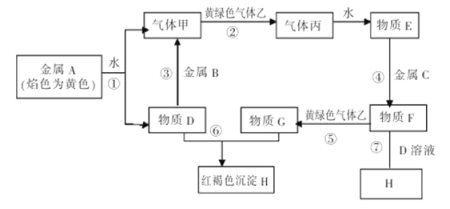
请根据以上信息回答下列问题:
(1)物质F的化学式为 。
(2)说出黄绿色气体乙的一种用途 。
(3)区别E、F两种溶液最简单的方法是 ,实验室检验G中所含的金属离子时,常在G的溶液中加入 溶液。
(4)反应①的离子方程式为 。
(5)物质F→H的转化需经过两个连续进行的反应,请写出这两个反应的化学方程式: 、 。
【答案】(1)FeCl2;(2)制取盐酸、水消毒、制取漂白粉等;
(3)滴加紫色石蕊试液,溶液变为红色就是盐酸,否则就是FeCl2;KSCN溶液
(4)2Na+2H2O=2Na++2OH-=H2↑;
(5)FeCl2+ 2NaOH=Fe(OH)2↓+2NaCl ;4Fe(OH)2 + O2+2H2O == 4Fe(OH)3 。
【解析】
试题分析:金属A焰色反应为黄色,则A是Na;Na与水反应产生的气体甲是H2,物质D是NaOH;黄绿色的气体乙是Cl2,氢气与氯气反应产生的气体丙是HCl,HCl溶于水得到溶液E是盐酸;金属B可以与NaOH反应产生氢气,则B是Al,金属C与盐酸反应产生F与氯气反应产生的G可以与NaOH溶液反应产生红褐色沉淀H,则C是Fe,F是FeCl2,G是FeCl3,H是Fe(OH)3。(1)物质F的化学式为FeCl2;(2)黄绿色气体乙是氯气,可用于制取盐酸、水消毒、制取漂白粉等;(3)E是盐酸,F是FeCl2;E、F两种溶液最简单的方法可以利用酸碱指示剂遇不同物质表现的现象。向两种溶液中分别滴加2滴紫色石蕊试液,溶液变为红色则该物质是盐酸,若不变色,就证明该溶液是FeCl2;实验室检验FeCl3中所含的金属离子时,常在G的溶液中加入KSCN溶液,若溶液变为红色,就证明含有Fe3+;(4)金属钠与水发生反应产生氢氧化钠和氢气,所以反应①的离子方程式为2Na+2H2O=2Na++2OH-=H2↑;(5)物质F→H的转化需经过两个连续进行的反应,这两个反应的化学方程式是FeCl2+ 2NaOH=Fe(OH)2↓+2NaCl ;4Fe(OH)2 + O2+2H2O == 4Fe(OH)3 。


科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学利用下图所示实验装置进行某些气体的制备、性质等试验(图中夹持装置有省略)。请按要求填空:
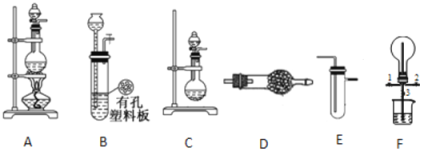
I.探究氯气与氨气的反应
(1)为制取干燥氨气,可将装置C与 (填装置编号)连接;装置C中的烧瓶内固体宜选用 。
a.碱石灰 b.氯化钙 c.五氧化二磷 d.生石灰
(2)装置A、E、E连接可制取纯净、干燥的氯气,则两个E装置内的药品依次是 。
(3)装置F可用于探究氯气与氨气(已知氯气与 氨气可发生反应:3Cl2+2NH3=N2+6HCl)的反应。实验时打开开关1、3,关闭2,先向烧瓶中通入 ,然后关闭1、3,打开2,向烧瓶中缓慢通入一定量的另一种气体。实验一段时间后烧瓶内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体中的阳离子 。
Ⅱ.探究某些物质的性质
(4)利用装置A、E,可设计实验比较Cl-和Br-的还原性强弱,能证明结论的实验现象是 。
(5)若利用装置A、E进行乙烯与溴水反应的实验,写出反应的化学方程式 。
(6)将装置B、C分别与F相连后,进行H2S与SO2反应的实验。F的烧瓶中发生反应的化学方程式为 ;F的烧杯所起的作用是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2气体是一种常用的消毒剂,我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒。
(1)消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,在这个过程中,Fe2+、Mn2+的化合价升高,说明ClO2具有__________性。
(2)工业上可以通过下列方法制取ClO2,请完成该化学反应方程式:2KClO3+SO2=2ClO2+__________。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,是放热反应,当1molCl2参与反应时释放145kJ的热量,写出这个反应的热化学方程式:___________________。
(4)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8mg·L-1之间。碘量法可以检测水中ClO2的浓度,步骤如下:
Ⅰ.取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ.加入一定量的Na2S2O3溶液。(已知:2S2O![]() +I2=S4O
+I2=S4O![]() +2I-)
+2I-)
Ⅲ.加硫酸调节水样pH至1~3。
操作时,不同pH环境中粒子种类如下图所示:
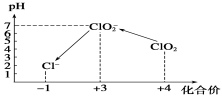
请回答:
①操作Ⅰ中反应的离子方程式是______________________。
②确定操作Ⅱ完全反应的现象是___________________。
③在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是____________________。
④若水样的体积为1.0 L,在操作Ⅱ时消耗了1.0×10-3 mol·L-1的Na2S2O3溶液10 mL,则水样中ClO2的浓度是________mg·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1﹣氯丙烷跟NaOH的醇溶液共热,生成的产物再跟溴水反应,得到一种有机物,它的同分异构体有(除它之外)( )
A. 2种 B. 3种 C. 4种 D. 5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
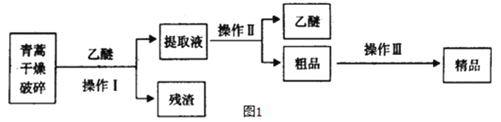
请回答下列问题:
(1)对青蒿进行干燥破碎的目的是_____________。
(2)操作I需要的玻璃仪器主要有:烧杯、玻璃棒、___________,操作Ⅱ的名称是_________,操作Ⅲ的名称是_____________。
(3)通常用燃烧的方法测定有机物的分子式,可在燃烧室内将有机物样品与纯氧在电炉加热下充分燃烧,根据产品的质量确定有机物的组成.如图所示的是用燃烧法确定青蒿素分子式的装置.
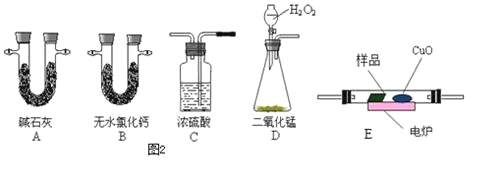
① 按上述所给的测量信息,装置的连接顺序应是__________________(每个装置限用一次)。
② 该实验装置可能会产生误差,造成测定含氧量偏低,改进方法是______________________________。
③ 青蒿素样品的质量为28.2 g,用合理改进后的装置进行试验,称得A管增重66 g,B管增重19.8 g,则测得青蒿素的最简式是__________________。
④ 要确定该有机物的分子式,还必须知道的数据是 。
(4)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与____________(填字母)具有相同的性质。
A.乙醇 | B.乙酸 | C.葡萄糖 | D.乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、请根据如下图所示转化关系回答有关问题。A和B均为钠盐的水溶液,A呈中性,B呈碱性并具有强氧化性。
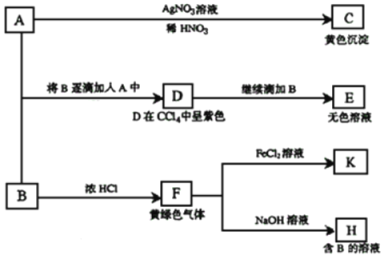
(1)写出A、B的化学式:A ,B 。
(2)依次写出A→D和D→E(E中含有某+5价元素的含氧酸根离子)的离子方程式: , 。
(3)写出将SO2气体通入K溶液中发生反应的离子方程式: 。
II、(1)将0.4gNaOH和1.06gNa2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。在如下图所示坐标系中画出能正确表示加入盐酸的体积和生成CO2的物质的量的关系图像。

(2)将18.4gNaOH和NaHCO3固体混合物,在密闭容器中加热到约250℃,经充分反应后排出气体,冷却,称得剩余固体质量为16.6g。试计算混合物中NaOH的质量分数。(请写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程没有发生化学反应的是( )
A、用活性炭去除冰箱中的异味
B、用热碱水清除炊具上残留的油污
C、用浸泡过高锰酸钾溶液的硅藻土保存水果
D、用含硅胶、铁粉的透气小袋与食品一起密封包装
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是中学化学常见单质, X、Y、Z、M、N、W、H、K是常见化合物,X是B和C的化合产物,它们之间有如下转化关系(反应物和产物中的H2O已略去):
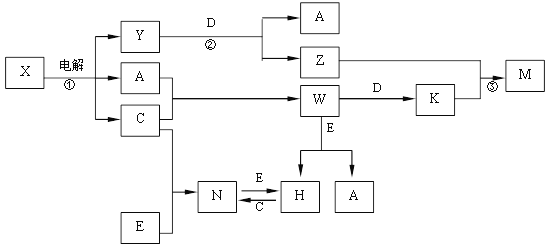
(1)Y的电子式为 ,构成E单质的元素在周期表中位于第 周期第 族
(2)反应①的离子方程式为
反应②的离子方程式为
反应③的离子方程式为
(3)某工厂用C制漂白粉。
①写出制漂白粉的化学方程式
②为测定该工厂制得的漂白粉中有效成分的含量,某小组进行了如下实验:称取漂白粉2.0g,研磨后溶解,配制成250mL溶液,取出25.00mL加入到锥形瓶中,再加入过量的KI溶液和过量的硫酸,此时发生的离子方程式为:
静置。待完全反应后,用0.1mol·L-1的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为:2Na2S2O3+I2=Na2S4O6+2NaI,共用去Na2S2O3溶液20.00mL。则该漂白粉中有效成分的质量分数为 (保留到小数点后两位)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com