
【题目】某同学利用如图所示装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质。
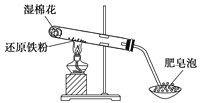
(1)试管中发生反应的化学方程式为_______________________________。
(2)该同学欲确定反应一段时间后试管中固体物质的成分,设计了如下方案:
①待试管冷却,取其中固体少许溶于稀盐酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红,则试管中固体是________(只有一个选项符合题意),若溶液未变红,则试管中固体是________(只有一个选项符合题意)。
A.一定有Fe3O4,可能有Fe
B.只有Fe(OH)3
C.一定有Fe3O4和Fe
D.一定有Fe(OH)3,可能有Fe
E.只有Fe3O4
(3)该同学按上述方案进行了实验,溶液未变红色,原因是: __________________________(用离子方程式表示)。
(4)该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按右图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关反应的化学方程式__________________________________________________,______________________________________。
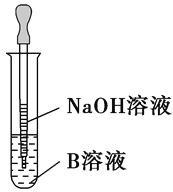
(5)一段时间后,该同学发现(3)中未变红的溶液变成红色。由此可知,实验室FeCl2溶液需现用现配的原因是___________________________________,并且配制时应加入少量________。
【答案】 3Fe+4H2O(g)![]() Fe3O4+4H2 A C 2Fe3++Fe===3Fe2+ FeCl2+2NaOH===Fe(OH)2↓+2NaCl 4Fe(OH)2+O2+2H2O===4Fe(OH)3 FeCl2易被空气氧化为FeCl3 铁粉
Fe3O4+4H2 A C 2Fe3++Fe===3Fe2+ FeCl2+2NaOH===Fe(OH)2↓+2NaCl 4Fe(OH)2+O2+2H2O===4Fe(OH)3 FeCl2易被空气氧化为FeCl3 铁粉
【解析】(1)铁与水蒸气高温下反应生成Fe3O4和H2,反应方程式:3Fe+4H2O(g)![]() Fe3O4+4H2;
Fe3O4+4H2;
(2)滴加KSCN后,若溶液变红色则说明溶液中有Fe3+,但不能排除溶液中是否有Fe2+,所以硬质试管中固体物质的成分一定有Fe3O4,可能有Fe,故选A;若溶液未变红色则说明溶液中无Fe3+,则一定有未反应完的Fe把Fe3+还原为Fe2+,硬质试管中固体物质的成分一定有Fe3O4和Fe,故选C。故答案为:A;C。
(3)Fe把Fe3+还原为Fe2+,离子方程式为:2Fe3++Fe=3Fe2+。
(4)取少量溶液B,使其跟NaOH溶液反应,生成白色沉淀,则白色沉淀为Fe(OH)2,溶液B中含有FeCl2,反应方程式为:FeCl2+2NaOH=Fe(OH)2↓+2NaCl;Fe(OH)2具有还原性,易被空气中氧气氧化生成Fe(OH)3,反应的方程式:4Fe(OH)2+O2+2H2O=4Fe(OH)3。故答案为:FeCl2+2NaOH=Fe(OH)2↓+2NaCl;4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(5)一段时间后,该同学发现(3)中未变红的溶液变成红色,则(3)中Fe2+易被空气中的氧气氧化为Fe3+,所以实验室FeCl2溶液需现用现配,且配制时在溶液中加入少量的铁粉,防止Fe2+被氧化。故答案为:FeCl2易被空气氧化为FeCl3;铁粉。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】实验:①0.1molL﹣1AgNO3溶液和0.1molL﹣1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;
②向滤液b中滴加0.1molL﹣1KI溶液,出现浑浊;
③向沉淀c中滴加0.1molL﹣1KI溶液,沉淀变为黄色.
下列分析不正确的是( )
A. 浊液a中存在沉淀溶解平衡:AgCl(s)![]() Ag+(aq)+Cl﹣(aq)
Ag+(aq)+Cl﹣(aq)
B. 滤液b中不含有Ag+
C. ③中颜色变化说明AgCl转化为AgI
D. 实验可以证明AgI比AgCl更难溶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如何降低大气中CO2的含量及有效地开发利用CO2是当前科学家研究的重要课题。
(1)科学家用H2和CO2生产甲醇燃料。为探究该反应原理,进行如下实验:某温度下,在容积为2 L的密闭容器中充入1 mol CO2和3.25 mol H2,在温度一定的条件下反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化关系如图所示。
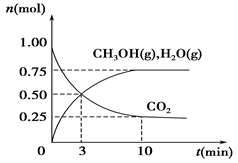
①从反应开始到3 min时,氢气的平均反应速率v(H2)=________。
②下列措施中一定能使CO2的转化率增大的是________。
A.在原容器中再充入1 mol CO2 B.在原容器中再充入1 mol H2
C.在原容器中充入1 mol He D.使用更有效的催化剂
E.缩小容器的容积 F.将水蒸气从体系中分离出
③能说明反应已达平衡状态的是________(填字母,下同)。
A.v(H2)=3v(CO2) B.容器内压强保持不变
C.v逆(CO2)=v正(CH3OH) D.容器内密度保持不变
(2)科学家还利用氢气在一定条件下与二氧化碳反应生成乙醇燃料,其热化学反应方程式为2CO2(g)+6H2(g) ![]() CH3CH2OH(g)+3H2O(g) ΔH=a kJ·mol-1,在一定压强下,测得该反应的实验数据如表所示。请根据表中数据回答下列问题。
CH3CH2OH(g)+3H2O(g) ΔH=a kJ·mol-1,在一定压强下,测得该反应的实验数据如表所示。请根据表中数据回答下列问题。
n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
1.5 | 45 | 33 | 20 | 12 |
2 | 60 | 43 | 28 | 15 |
3 | 83 | 62 | 37 | 22 |
①上述反应的a________0(填“大于”或“小于”)。
②恒温下,向反应体系中加入固体催化剂,则反应产生的热量________(填“增大”“减小”或“不变”)。
③增大![]() 的值,则生成乙醇的物质的量________(填“增大”“减小”“不变”或“不能确定”)。
的值,则生成乙醇的物质的量________(填“增大”“减小”“不变”或“不能确定”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是( )

A. a点对应的溶液中:Na+、Fe3+、SO42-、HCO3-
B. b点对应的溶液中:Na+、S2-、SO42-、Cl-
C. c点对应的溶液中:Ag+、Ca2+、NO3-、F-
D. d点对应的溶液中:K+、NH4+、I-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示,关于这两种晶体的说法,正确的是( )
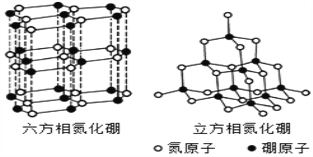
A. 立方相氮化硼含有σ键和π键,所以硬度大
B. 六方相氮化硼层间作用力小,所以质地软
C. 两种晶体中硼原子和氮原子之间的作用力不同
D. 两种晶体均为分子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述不正确的是( )
A. 人造刚玉熔点很高,可用作高级耐火材料,主要成分是Al2O3
B. 在医疗上碳酸氢钠可用于治疗胃酸过多
C. 用于现代通讯的光导纤维的主要成分是高纯度的硅
D. 分散系中分散质粒子的直径:Fe(OH)3 悬浊液>Fe(OH)3 胶体>FeCl3 溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为实验室制取纯净、干燥的 Cl2,并进行检验 Cl2性质的实验装置。其中 D 瓶中放有干燥的红色布条;E 中为铜网,E 右端出气管口附近为棉球。试回答:
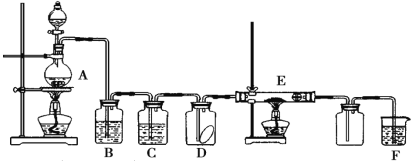
(1)A 中发生反应的化学方程式为_____; 制得 2mol Cl2时,转移的电子为______mol。
(2)为得到干燥纯净的氯气,一般在 B 瓶中加入_____; 装置 C 的作用是______。
(3)D 中现象为_______。
(4)F 中反应的离子方程式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com