
【题目】其它条件不变,适当升高温度,下列数据不一定增大的是
A. 化学平衡常数K B. 反应热 Q C. 化学反应速率v D. 水的离子积常数Kw
科目:高中化学 来源: 题型:
【题目】高铁电池是电动汽车首选的电池之一,该电池的工作原理为:
3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,
3Zn(OH)2+2Fe(OH)3+4KOH,
下列关于该电池放电时的说法中正确的是( )
A.高铁电池产生的电流从负极经外电路到达正极
B.正极反应式为Zn+2OH--2e - =Zn(OH)2
C.负极pH减小,正极pH增大,电解液pH增大
D.每氧化1mol高铁酸钾转移3mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4和H2O(g)可发生催化重整反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g)。
CO(g)+3H2(g)。
(1)每消耗8g CH4转移的电子的数目为 。
(2)已知:①2CO(g)+O2(g)=2CO2(g) △H1=akJ·mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) △H2=bkJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H3=ckJ·mol-1
④CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H4
CO(g)+3H2(g) △H4
由此计算△H4= kJ·mol-1。
(3)T℃时,向1L恒容密闭容器中投入1molCH4和1molH2O(g),发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g),经过tmin,反应达到平衡。已知平衡时,c(CH4)=0.5mol·L-1。
CO(g)+3H2(g),经过tmin,反应达到平衡。已知平衡时,c(CH4)=0.5mol·L-1。
①0~tmin内,该反应的平均反应速率v(H2)= 。②T℃时,该反应的平衡常数K= 。
③当温度升高到(T+100)℃时,容器中c(CO)="0.75" mol·L-1,则该反应是 反应(填“吸热”或“放热”)。
(4)已知熔融碳酸盐燃料电池的工作原理示意图如下:
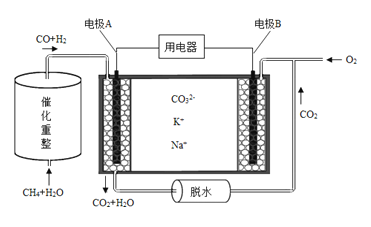
①放电过程中K+和Na+向电极 (填“A”或“B”)移动。
②该电池的负极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同类型的稀有气体的氟化物结构相似,已知二氟化氪KrF2是非极性分子,下列关于二氟化氙XeF2的说法正确的是
A. 各原子最外层均达到8电子稳定结构 B. 熔沸点高于KrF2
C. 分子构型为折线(V字)形 D. 所含的化学键为非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式不正确的是( )
A.明矾净水:Al3+ + 3H2O ![]() Al(OH)3(胶体)+ 3H+
Al(OH)3(胶体)+ 3H+
B.用稀HNO3清洗试管内壁上的银:Ag + 2H+ + NO3-═ Ag+ + NO2↑+ H2O
C.实验室盛装NaOH溶液的试剂瓶不能用玻璃塞:SiO2 + 2OH-═ SiO32- + H2O
D.焊接钢轨:2Al+Fe2O3![]() 2Fe+Al2O3
2Fe+Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)![]() 2Z(g),各组分在不同时刻的浓度如下表:
2Z(g),各组分在不同时刻的浓度如下表:
物质 | X | Y | Z |
初始浓度/(mol·L-1) | 0.1 | 0.2 | 0 |
2min末浓度/(mol·L-1) | 0.08 | a | b |
平衡浓度/(mol·L-1) | 0.05 | 0.05 | 0.1 |
下列说法正确的是
A.平衡时,X的转化率为20%
B.2min时Y的物质的量为0.14
C.增大平衡后的体系压强,v(正)增大,v(逆)减小
D.2min内,用Y的变化量表示的平均反应速率v(Y)=0.03mol·L―1·min―1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
A. 组成细胞的元素和细胞中的无机盐均主要以离子的形式存在
B. 组成麦芽糖、乳糖、纤维素、糖原的单体都是葡萄糖
C. 有些蛋白质起信息传递作用,能够调节机体的生命活动,如胰岛素、雄性激素的
D. 核酸、磷脂都含有C、H、O、P、N、P
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二茂铁[(C5H5)2Fe]的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究的新领域。已知二茂铁熔点是173 ℃(在100 ℃时开始升华),沸点是249 ℃,不溶于水,易溶于苯、乙醚等非极性溶剂。下列说法不正确的是( )
A. 二茂铁属于分子晶体
B. 在二茂铁结构中,C5H![]() 与Fe2+之间形成的化学键类型是离子键
与Fe2+之间形成的化学键类型是离子键
C. 已知:环戊二烯的结构式为: ,则其中仅有1个碳原子采取sp3杂化
,则其中仅有1个碳原子采取sp3杂化
D. C5H![]() 中一定含π键
中一定含π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器内,800℃时反应2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=________。已知:K300℃>K350℃,则该反应是________热反应。
(2)图中表示NO2的变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=________。
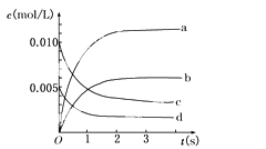
(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
e.颜色不再改变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是________
a.及时分离出NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com