
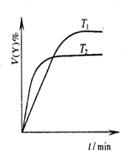
A.图1表示可逆反应“2X(g) Y(g)△H <0”,温度T1<T2的情形 Y(g)△H <0”,温度T1<T2的情形 |
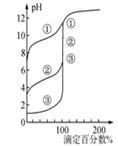
| B.用0.1000 mol·L-1NaOH溶液分别滴定浓度相同的三种一元酸,由图2曲线可确定①的酸性最强 |
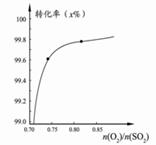
C.在其它条件不变时,2SO2(g) +O2(g)  2SO3(g)转化关系(如图3)中,纵坐标表示O2的转化率 2SO3(g)转化关系(如图3)中,纵坐标表示O2的转化率 |
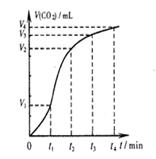
| D.图4表示碳酸钙与盐酸反应收集到气体最多的时间段是t3~t4 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题
 4NO(g)+6H2O (g) ΔH=" -1025" KJ/mol
4NO(g)+6H2O (g) ΔH=" -1025" KJ/mol 
| 时间/浓度 | c(NH3)(mol/L) | C(O2)(mol/L) | C(NO)(mol/L) |
| 起始 | 0.8 | 1.5 | 0 |
| 第2min | 0.7 | a | 0.1 |
| 第4min | 0.4 | 1.0 | 0.4 |
| 第6min | 0.4 | 1.0 | 0.4 |
| 第8min | 1.2 | 2.5 | 0.4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
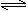 2NH3(g) △H<0,下列研究目的和示意图相符的是( )
2NH3(g) △H<0,下列研究目的和示意图相符的是( )| | A | B | C | D |
| 研究 目的 | 压强对反应的影响 (p2>p1) | 温度对反应的影响 | 平衡体系增加N2的 浓度对反应的影响 | 催化剂对反应的影响 |
| 图 | 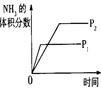 |  | 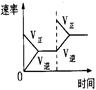 | 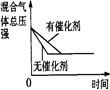 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Z(g) △H<0分两步进行:
Z(g) △H<0分两步进行: W(g) △H>0和W(g)
W(g) △H>0和W(g) Z(g) △H<0。下列图示有关该反应的信息不合理的是
Z(g) △H<0。下列图示有关该反应的信息不合理的是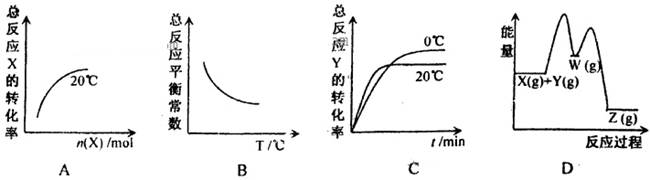
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
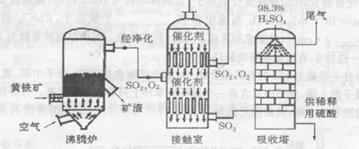
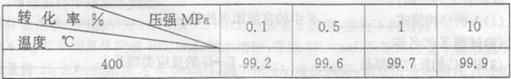
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 C(g)+D(g)的化学平衡常数和温度的关系如下:
C(g)+D(g)的化学平衡常数和温度的关系如下:| 温度(℃) | 700 | 800 | 830 | 1000 | 1200 |
| 化学平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
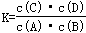
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
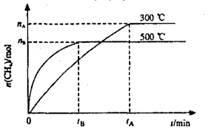
A.101KPa、120℃时,该反应的平衡常数表达式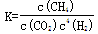 |
| B.断裂lmolC=O、2molH—H所吸收的能量小于形成2molC—H、2molO—H所释放的能量 |
C.300℃时,从反应开始达到平衡的这段时间,化学反应速率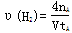 |
| D.其它条件不变,减小容器体积,二氧化碳的平衡转化率增大,平衡常数不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 W (s) + 3H2O (g) 请回答下列问题:
W (s) + 3H2O (g) 请回答下列问题: WI4 (g)。下列说法正确的有__________。
WI4 (g)。下列说法正确的有__________。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2SO3 (g)。若经过2s后测得SO3的浓度为0.6 mol/ L。试计算:(1)O2的化学反应速率V(O2)= ; (2)2s时的O2浓度 。
2SO3 (g)。若经过2s后测得SO3的浓度为0.6 mol/ L。试计算:(1)O2的化学反应速率V(O2)= ; (2)2s时的O2浓度 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com