
分析 依据离子性质分析,弱离子水解,酸式酸根离子可以电离、水解,根据水的电离平衡的影响因素来回答判断.
解答 解:①Na+ 是强碱阳离子不水解也不电离;
②ClO- 是弱酸阴离子水溶液中水解;
③NH4+ 是弱碱阳离子水溶液中水解;
④HSO3-是弱酸阴离子水溶液中水解,也存在电离平衡;
⑤HCO3- 是弱酸阴离子水溶液中水解,也存在电离平衡;
⑥HS- 是弱酸阴离子水溶液中水解,也存在电离平衡;
⑦CO32- 是弱酸阴离子水溶液中水解,不存在电离平衡;
⑧Cl-是强酸阴离子不水解也不电离;
既能参与电离平衡,又能参与水解平衡的是④⑤⑥,既不能参与电离平平衡,又不能参与水解平衡的是①⑧,只能参与水解平衡的是②③⑦,
故答案为:④⑤⑥;①⑧;②③⑦.
点评 本题考查了离子性质的分析判断,离子水解和电离的分析,盐类水解应用,理解铵盐能和显碱性的物质发生化学反应生成氨气,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | 分散系的分类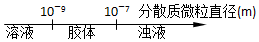 | |
| B. | Fe与Cl2反应的产物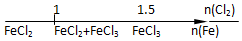 | |
| C. | 向AlCl3溶液滴加NaOH溶液后铝的存在形式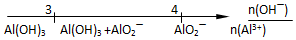 | |
| D. | Na与O2反应的产物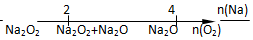 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molO2参加反应转移电子数一定为4NA | |
| B. | 一定条件下,足量铜与2 mol的浓硫酸充分反应,转移电子数为2NA | |
| C. | 300mL2mol/L乙醇溶液中所含乙醇分子数为0.6NA | |
| D. | 标准状况下,22.4L氦气与22.4L氟气所含原子数均为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. ,反应类型是酯化反应(或取代反应).
,反应类型是酯化反应(或取代反应). .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(NO3 )2(溶液) | B. | K2CO3(溶液) | C. | CH3COOK(固体) | D. | CuSO4 (固体) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入CO2气体产生蓝色沉淀 | |
| B. | 该溶液中Na+、NH4+、NO3-、Mg2+可以大量共存 | |
| C. | 与H2S反应的离子方程式:Cu2++S2-=CuS↓ | |
| D. | 与过量浓氨水反应的离子方程式:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若X、Y位于 IA族,则X、Y可能与氧元素形成原子个数比为1:1或2:1的化合物 | |
| B. | 若X、Y位于第3周期,则X、Y形成的化合物可能是离子化合物或共价化合物 | |
| C. | 若气态氢化物的沸点:X>Y,则X、Y只能位于周期表 VIIA族 | |
| D. | 若X、Y位于周期表的同一周期,则最高价含氧酸的酸性可能是HnXOm>HaYOb |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型.
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型. ;
; .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com