
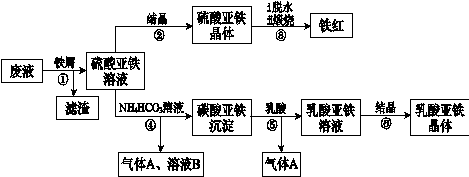
 Fe2+(aq)+ CO32-(aq) CO32-与乳酸反应浓度降低,平衡向右移动,使碳酸亚铁溶解得到乳酸亚铁溶液(2分)
Fe2+(aq)+ CO32-(aq) CO32-与乳酸反应浓度降低,平衡向右移动,使碳酸亚铁溶解得到乳酸亚铁溶液(2分) 

科目:高中化学 来源:不详 题型:单选题
| A.工业上,用焦炭在电炉中还原二氧化硅得到含杂质的粗硅 |
| B.生产普通水泥的主要原料有石灰石、石英和纯碱 |
| C.工业上将粗铜电解精炼,应将粗铜连接电源的正极 |
| D.在高炉炼铁的反应中,一氧化碳作还原剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

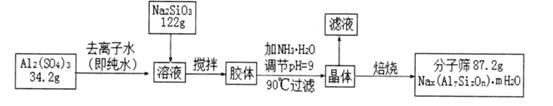
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
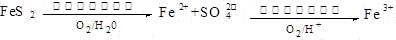
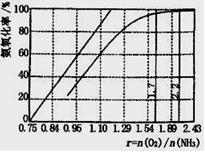
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
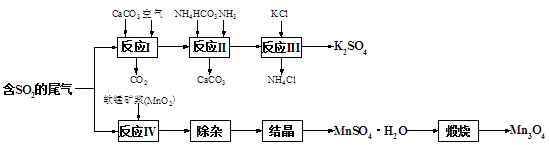
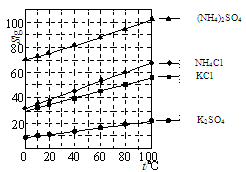

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.②③⑥⑦ | B.①④⑤ | C.③⑥⑦⑧ | D.①②④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①④⑤ | B.②③⑥⑦ | C.③⑥⑦⑧ | D.①②④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.(I)用① | B.(Ⅱ)用② | C.(Ⅲ)用③ | D.(Ⅳ)用④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com