
| A.工业上,用焦炭在电炉中还原二氧化硅得到含杂质的粗硅 |
| B.生产普通水泥的主要原料有石灰石、石英和纯碱 |
| C.工业上将粗铜电解精炼,应将粗铜连接电源的正极 |
| D.在高炉炼铁的反应中,一氧化碳作还原剂 |
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源:不详 题型:填空题
A.2HgO 2Hg+O2↑ 2Hg+O2↑ | B.Fe3O4+4CO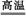 3Fe+4CO2 3Fe+4CO2 |
C.2MgO 2Mg+O2↑ 2Mg+O2↑ | D.2Ag2O 4Ag+O2↑ 4Ag+O2↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂 |
| B.上述反应中每生成2 mol AlN,N2得到3 mol电子 |
| C.氮化铝中氮元素的化合价为-3价 |
| D.氮化铝属于复合材料 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加热Al2O3 | B.加热HgO |
| C.电解熔融NaCl | D.铝粉和Fe2O3共热 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na、Mg、Al | B.Na、K、Zn、Fe |
| C.Zn、Fe、Cu、Ag | D.Mg、Al、Zn、Fe |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.蒸馏法; | B.电渗析法; | C.冷结法; | D.离子交换法;E.反渗透法 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
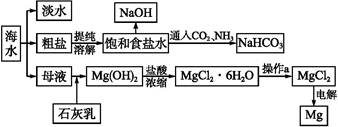
| | MgO | MgCl2 |
| 熔点/℃ | 2 852 | 714 |
| 沸点/℃ | 3 600 | 1 412 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
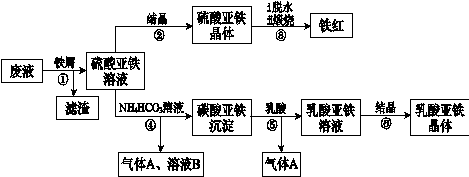
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com