
下列关于有机物的说法错误的是( )
A.由CH2=CHCOOCH3合成的聚合物为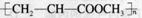
B.溴乙烷与NaOH乙醇溶液共热生成乙烯 C.装饰材料中的甲醛和芳香烃会造成居室污染
D.磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸
科目:高中化学 来源: 题型:
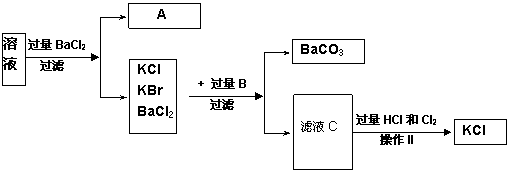
实验室需要制备纯净的氯化钾晶体。现有含少量KBr和K2SO4的氯化钾样品,按照下图所示的实验方案进行提纯。
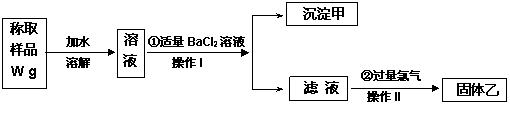
(1)操作I的名称 ,操作II所需的玻璃仪器有酒精灯和 。
(2)若用硝酸钡来代替氯化钡,是否可行?请说明理由。
。
(3)若实验所得固体甲、乙的质量分别为W1g和W2g,则样品中KBr的质量分数计算式为 。
(4)某同学对该实验方案提出质疑,他认为加适量氯化钡溶液不容易控制,应加入过量氯化钡溶液,请你按他的思路,写出实验流程图中所用试剂、所得产物的化学式和相应操作的名称,A ,B ,滤液C ,操作II 。
 |
查看答案和解析>>
科目:高中化学 来源: 题型:
催化剂在生产和科技领域起到重大作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
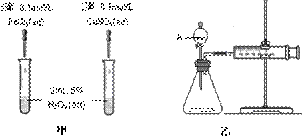
⑴ 定性分析:如图甲可通过观察 ,定性比较得出结论。同学X观察甲中两支试管产生气泡的快慢,由此得出Fe3+和Cu2+对H2O2分解的催化效果,其结论________(填“合理”或“不合理”),理由是 。
⑵ 定量分析:如图乙所示,实验时均以生成40 mL气体为准,其它可能影响实验的因素均已忽略。实验中检验气密性的方法是
,需要测量的数据是 。
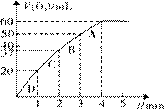 ⑶ 加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如右图所示。
⑶ 加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如右图所示。
① 实验时放出气体的总体积是 mL。
② 放出1/3气体所需时间为 min。
③ 计算H2O2的初始物质的量浓度 。 (请保留两位有效数字)
④ A、B、C、D各点反应速率快慢的顺序为_______>______>______>______。
⑤ 解释④反应速率变化的原因___ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学用语或模型表示正确的是( )
A.Cl-离子的结构示意图: B.CCl4分子的球棍模型:
B.CCl4分子的球棍模型:
C.乙烯的结构简式 CH2CH2 D.H2O2的结构式:H—O—O—H
查看答案和解析>>
科目:高中化学 来源: 题型:
化学在生产和日常生活中有着重要的作用。下列有关说法不正确的是( )
A.我国发射的“嫦娥三号”卫星中使用的碳纤 维,是一种新型无机非金属材料
维,是一种新型无机非金属材料
B.只要 符合限量,“食用色素”“碘元素”、“亚硝酸盐”可以作为某些食品的添加剂
符合限量,“食用色素”“碘元素”、“亚硝酸盐”可以作为某些食品的添加剂
C.氢氧化铁溶胶、水玻璃、淀粉溶液均具有丁达尔效应
D.“地沟油”经过加工处理后,可以用来制肥皂和生物柴油
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子能大量共存,向溶液中通入足量相应气体后,各离子还能大量存在的是( )
A.氯气:K+ Ba2+ SiO32- NO3-
B.二氧化硫:Na+ NH4+ SO32- C1-
C.氨气:K+ Na+ AlO2-. CO32-
D.甲醛:Ca2+ Mg2+ Mn04- NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术。反应①为主反应,反应②和③为副反应。
①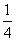 CaSO4(s)+CO(g)
CaSO4(s)+CO(g)
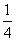 CaS(s)+CO2(g)
CaS(s)+CO2(g)
ΔH1=-47.3 kJ·mol-1
②CaSO4(s)+CO(g) CaO(s)+CO2(g)+SO2(g) ΔH2=+210.5 kJ·mol-1
CaO(s)+CO2(g)+SO2(g) ΔH2=+210.5 kJ·mol-1
③CO(g)
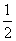 C(s)+
C(s)+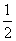 CO2(g) ΔH3=-86.2 kJ·mol-1
CO2(g) ΔH3=-86.2 kJ·mol-1
(1)反应2CaSO4(s)+7CO(g) CaS(s)+CaO(s)+6CO2(g) +C(s)+SO2(g)的ΔH=________(用ΔH1、ΔH2和ΔH3表示)。
CaS(s)+CaO(s)+6CO2(g) +C(s)+SO2(g)的ΔH=________(用ΔH1、ΔH2和ΔH3表示)。
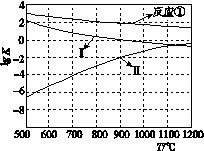
(2)反应①~③的平衡常数的对数lg K随反应温度T的变化曲线如图所示。结合各反应的ΔH,归纳lg K~T曲线变化规律:
a.________; b.________。
(3)向盛有CaSO4的真空恒容密闭容器中充入CO,反应①于900 ℃达到平衡,c平衡(CO)=8.0×10-5mol·L-1,计算CO的转化率(忽略副反应,结果保留两位有效数字)。
(4)为减少副产物,获得更纯净的CO2,可在初始燃料中适量加入________。
(5)以反应①中生成的CaS为原料,在一定条件下经原子利用率100%的高温反应,可再生CaSO4,该反应的化学方程式为______________________________________,在一定条件下,CO2可与对二甲苯反应,在其苯环上引入一个羧基,产物的结构简式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氢能是重要的新能源。储氢作为氢能利用的关键技术,是当前关注的热点之一。
(1)氢气是清洁燃料,其燃烧产物为________。
(2)NaBH4是一种重要的储氢载体,能与水反应得到NaBO2,且反应前后B的化合价不变,该反应的化学方程式为__________________________________________,反应消耗1 mol NaBH4时转移的电子数目为________。
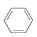
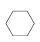 (3)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:
(3)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:
 (g)
(g) 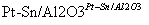 (g)+3H2(g)。
(g)+3H2(g)。
在某温度下,向恒容密闭容器中加入环己烷,其起始浓度为a mol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K=________。
(4)一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物)。
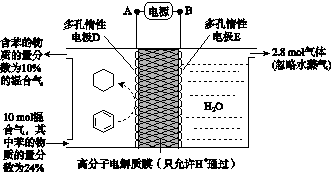
①导线中电子移动方向为________。(用A、D表示)
②生成目标产物的电极反应式为__________________。
③该储氢装置的电流效率η=____________________。(η=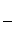 ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com