
【题目】下列实验方案中,能达到相应实验目的的是
A | B | C | D | |
方案 |
|
|
|
|
目的 | 分离甲烷和氯气发生反应后得到的液态混合物 | 验证石蜡油分解的产物是乙烯 | 检验乙烯、乙炔混合气中的乙烯 | 制备并检验乙炔的性质 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】下列实验方案或实验结论不正确的是( )
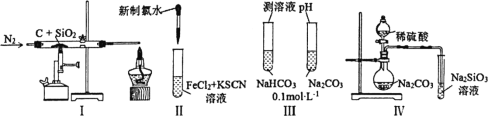
A.图Ⅰ结论,元素非金属性:C>Si
B.图Ⅱ结论,氧化性:Cl2>Fe3+
C.图Ⅲ结论,溶液pH:Na2CO3>NaHCO3
D.图Ⅳ结论,酸性:H2SO4>H2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
_SiO2+_C+_N2![]() _Si3N4+_CO
_Si3N4+_CO
(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)该反应的氧化剂是___,其还原产物是___;
(3)该反应的平衡常数表达式为K=___;
(4)若知上述反应为放热反应,则其反应热△H___0(填“>”、“<”或“=”);升高温度,其平衡常数值___(填“增大”、“减小”或“不变”);
(5)若使压强增大,则上述平衡向___反应方向移动(填“正”或“逆”);
(6)若已知CO生成速率为v(CO)=18mol/(L·min),则N2消耗速速率为v(N2)=___mol/(L·min)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R是短周期元素,原子序数依次增大。X原子核外各层电子数之比为1∶2,Y原子和Z原子的核外电子数之和为20,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨。请回答下列问题:
(1)元素X的最高价氧化物的电子式为________;元素Z的离子结构示意图为________。
(2)单质铜和元素Y的最高价氧化物对应水化物的稀溶液发生反应的化学方程式为_______________________________________________________。
(3)元素W位于周期表的第________族,其非金属性比R弱,用原子结构的知识解释原因:_____________________________________________________________。
(4)R的一种氧化物能使品红溶液褪色,工业上用Y的气态氢化物的水溶液作该氧化物的吸收剂,写出吸收剂与足量该氧化物反应的离子方程式:__________________________________。
(5)Y和Z组成的化合物ZY,被大量用于制造电子元件。工业上用Z的氧化物、X单质和Y单质在高温下制备ZY,其中Z的氧化物和X单质的物质的量之比为1∶3,则该反应的化学方程式为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用NaI溶液中通入少量Cl2得到含碘废液,再利用含碘废液获取NaI固体,实验流程如下:

已知反应②:2I﹣+2Cu2++![]() +H2O
+H2O![]() 2CuI↓+
2CuI↓+![]() +2H+。
+2H+。
回答下列问题:
(1)过滤实验所需要的玻璃仪器有普通漏斗、烧杯、_____________。
(2)反应③中CuI被氧化,还原产物只有NO2,该反应的化学方程式为_________________。当有95.5 g CuI参与反应,则需要标况下______________L的O2才能将生成的NO2在水中完全转化为硝酸。
(3)化合物B中含两种元素,铁原子与另一种元素原子的物质的量之比为3∶8,则化合物B的化学式为_____________。
(4)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,则反应⑤的化学方程式为______。
(5)将足量的Cl2通入含12 g NaI的溶液中,一段时间后把溶液蒸干得到固体的质量为_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂电池是新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂电池。某种锂电池的总反应为:Li+MnO2=LiMnO2,下列说法正确的是( )
A.锂是正极,电极反应为:Li-e-=Li+B.锂是负极,电极反应为:Li-e-=Li+
C.锂是负极,电极反应为:MnO2+e-=MnO![]() D.锂是负极,电极反应为:Li-2e-=Li2+
D.锂是负极,电极反应为:Li-2e-=Li2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】张亭栋研究小组受民间中医启发,发现As2O3(俗称砒霜)对白血病有明显的治疗作用。氮(N)、磷(P)、砷(As)等都是VA族的元素,该族元素的化合物在研究和生产中有许多重要用途。回答下列问题:
(1)NH3的沸点比PH3_____(填“高"或“低”),原因是_____________。
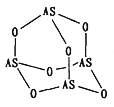
(2)Na3AsO4 中含有的化学键类型包括_______;AsO43-的空间构型为_______,As4O6的分子结构如图所示,则在该化合物中As的杂化方式是_________。
(3)自然固氮现象发生的一系列化学变化:N2→NO→NO2→HNO3→NO3-解释了民谚“雷雨发庄稼”的原理。
①NO3-中N原子采取_____杂化方式,其空间构型为________,写出它的一种等电子体的化学式________.
②已知酸性: HNO3>HNO2,下列相关见解合理的是_________.
A.含氧酸中氧原子总数越多,酸性越强
B.同种元素化合价越高,对应含氧酸的酸性越强
C.HNO3中氮元素的正电性更高,在水溶液中更易电离出H+,酸性强于HNO2
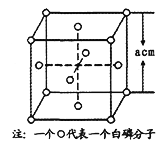
(4)白磷(P4)的晶体属于分子晶体,其晶胞结构如图(小圆圈表示白磷分子)。己知晶胞的边长为acm,阿伏加德罗常数为NA mol-1,则该晶胞中含有的P原子的个数为______,该晶体的密度为______g·cm-3(用含NA、a的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素①~⑦在周期表中的相对位置如图所示。
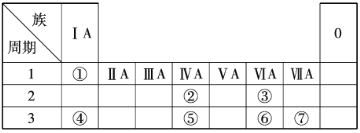
请回答下列问题。
(1)⑤的元素符号是____________,其最高正化合价是____________。
(2)①~⑦中金属性最强的是____________(填元素符号),能证明⑥比②的非金属性强的事实是____。
(3)③④形成的化合物是____________或____________。
(4)④⑥⑦原子半径由大到小的顺序是__________________(用元素符号表示);④的最高价氧化物对应的水化物是____________,它与⑥的最高价氧化物对应的水化物反应的离子方程式是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,分别向20mL浓度均为xmol/L的NaCl和Na2CrO4溶液中滴加0.1mol/LAgNO3溶液,滴加过程中![]() 和
和![]() 与AgNO3溶液的体积关系如图所示。下列说法不正确的是
与AgNO3溶液的体积关系如图所示。下列说法不正确的是
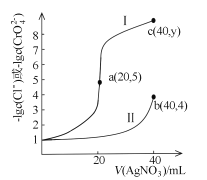
A.x =0.1B.曲线I代表NaCl溶液
C.Ksp(Ag2CrO4)约为4×10-12D.y=9
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com