
【题目】X、Y、Z、W、R是短周期元素,原子序数依次增大。X原子核外各层电子数之比为1∶2,Y原子和Z原子的核外电子数之和为20,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨。请回答下列问题:
(1)元素X的最高价氧化物的电子式为________;元素Z的离子结构示意图为________。
(2)单质铜和元素Y的最高价氧化物对应水化物的稀溶液发生反应的化学方程式为_______________________________________________________。
(3)元素W位于周期表的第________族,其非金属性比R弱,用原子结构的知识解释原因:_____________________________________________________________。
(4)R的一种氧化物能使品红溶液褪色,工业上用Y的气态氢化物的水溶液作该氧化物的吸收剂,写出吸收剂与足量该氧化物反应的离子方程式:__________________________________。
(5)Y和Z组成的化合物ZY,被大量用于制造电子元件。工业上用Z的氧化物、X单质和Y单质在高温下制备ZY,其中Z的氧化物和X单质的物质的量之比为1∶3,则该反应的化学方程式为______________________________________。
【答案】![]()
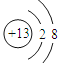 8HNO3(稀)+3 Cu=2NO↑+3Cu(NO3)2+4H2O ⅤA P原子和S原子的电子层数相同,P原子半径较大,得电子能力较弱 SO2+NH3·H2O=HSO3-+NH4+ Al2O3+3 C+N2
8HNO3(稀)+3 Cu=2NO↑+3Cu(NO3)2+4H2O ⅤA P原子和S原子的电子层数相同,P原子半径较大,得电子能力较弱 SO2+NH3·H2O=HSO3-+NH4+ Al2O3+3 C+N2![]() 2 AlN+3CO
2 AlN+3CO
【解析】
X、Y、Z、W、R是短周期元素,原子序数依次增大。X原子核外各层电子数之比为1∶2,,则为碳元素, Y的氧化物和R的氧化物均能形成酸雨,为二氧化氮和二氧化硫,则Y为氮元素,R为硫元素。Y原子和Z原子的核外电子数之和为20,Z为铝元素,W和R是同周期相邻元素,为磷元素。
(1)X为碳元素,其最高价氧化物为二氧化碳,电子式为![]() ;Z为铝元素,原子结构示意图为
;Z为铝元素,原子结构示意图为 。
。
(2)铜与氮元素的最高价氧化物对应的水化物的稀溶液即稀硝酸反应生成硝酸铜和一氧化氮和水,方程式为:8HNO3(稀)+3Cu=2NO↑+3Cu(NO3)2+4H2O。
(3)W为磷元素,在ⅤA族。因为P原子和S原子的电子层数相同,P原子半径较大,得电子能力较弱。
(4)二氧化硫能使品红褪色,工业上用氨气吸收过量的二氧化硫,生成亚硫酸氢铵,故离子方程式为:SO2+NH3·H2O=HSO+NH。
(5)Z的氧化物为氧化铝,X为碳,Y为氮气,三者在高温下反应生成氮化铝,因为Z的氧化物和X单质的物质的量之比为1∶3,所以产物为一氧化碳,方程式为:Al2O3+3C+N2![]() 2AlN+3CO。
2AlN+3CO。


科目:高中化学 来源: 题型:
【题目】实验室配制500mL0.1mol/LNa2CO3溶液回答下列问题
(1)应用托盘天平称取十水碳酸钠晶体_______g
(2)若在称量样品时,药品放在天平右盘上,磕码放在天平左盘上,天平平衡时,则实际称量的碳酸钠晶体是______g(1g以下用游码)
(3)用托盘天平和小烧杯称出碳酸钠晶体的质量,其正确操作顺序的标号为_________(同一步骤可用多次)
A、调整零点 B、将游码移至刻度尺的零刻度处
C、将碳酸钠晶体放入小烧杯中称量 D、称量空的小烧杯
E、将砝码放回砝码盒内 F、记录称量结果.
(4)配制Na2CO3溶液时需用的主要仪器有____________________
(5)若实验遇下列情况,溶液的浓度是偏高,偏低还是不变?
A、加水时越过刻度线_________ B、忘记将洗涤液加入容量瓶__________
C、容量瓶内壁附有水珠而未干燥处理______ D、溶解后没有冷却便进行定容_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组性质比较中,正确的是()
①沸点:![]()
②离子还原性:![]()
③酸性:![]()
④金属性:![]()
⑤气态氢化物稳定性:![]()
⑥半径:![]()
A.①②③B.③④⑤⑥C.②③④D.①③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烷烃的结构简式是CH3CH2CH(CH2CH3)CH3,它的正确命名是
A. 2-乙基丁烷 B. 3-乙基丁烷
C. 3-甲基戊烷 D. 2,2-二甲基丁烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高纯H2为燃料的质子交换膜燃料电池具有能量效率高、无污染等优点,但燃料中若混有CO将显著缩短电池寿命。
以甲醇为原料制取高纯H2是重要研究方向。甲醇水蒸气重整制氢主要发生以下两个反应:主反应:
CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H=+49kJmol-1
副反应:H2(g)+CO2(g)=CO(g)+H2O(g) △H=+41kJmol-1
①甲醇蒸气在催化剂作用下裂解可得到H2和CO,则该反应的热化学方程式为__,既能加快反应速率又能提高CH3OH平衡转化率的一种措施是__。
②分析适当增大水醇比![]() 对甲醇水蒸气重整制氢的好处是___。
对甲醇水蒸气重整制氢的好处是___。
③某温度下,将![]() =1∶1的原料气充入恒容密闭容器中,初始压强为P1,反应达平衡时总压强为P2,则平衡时甲醇的转化率为___(忽略副反应)。
=1∶1的原料气充入恒容密闭容器中,初始压强为P1,反应达平衡时总压强为P2,则平衡时甲醇的转化率为___(忽略副反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列说法正确的是( )
A.7.8g苯所含碳碳双键数目为0.3NAB.28g乙烯所含共用电子对数目为5NA
C.标准状况下,11.2L乙醇所含分子数为0.5NAD.16g甲烷电子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案中,能达到相应实验目的的是
A | B | C | D | |
方案 |
|
|
|
|
目的 | 分离甲烷和氯气发生反应后得到的液态混合物 | 验证石蜡油分解的产物是乙烯 | 检验乙烯、乙炔混合气中的乙烯 | 制备并检验乙炔的性质 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X是固体,B和G是液体,其余均为气体。根据下图关系推断:

(1)写出化学式:X_______,A________,B_______。
(2)实验室收集气体D和F的方法依次是_______法、________法。
(3)写出C→E的化学方程式:____________。
(4)请写出A与E反应生成D的化学方程式:_______________
(5)检验物质A的方法和现象是________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种气态烷烃和一种气态烯烃,它们分子里的碳原子数相等.将1.0体积这种混合气体在氧气中完全燃烧,生成2.0体积的CO2和2.4体积的水蒸气(气体体积均在相同状况下测定),则混合气体中烷烃和烯烃的体积比为( )
A.3:1 B.1:3 C.2:3 D.3:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com