
【题目】以高纯H2为燃料的质子交换膜燃料电池具有能量效率高、无污染等优点,但燃料中若混有CO将显著缩短电池寿命。
以甲醇为原料制取高纯H2是重要研究方向。甲醇水蒸气重整制氢主要发生以下两个反应:主反应:
CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H=+49kJmol-1
副反应:H2(g)+CO2(g)=CO(g)+H2O(g) △H=+41kJmol-1
①甲醇蒸气在催化剂作用下裂解可得到H2和CO,则该反应的热化学方程式为__,既能加快反应速率又能提高CH3OH平衡转化率的一种措施是__。
②分析适当增大水醇比![]() 对甲醇水蒸气重整制氢的好处是___。
对甲醇水蒸气重整制氢的好处是___。
③某温度下,将![]() =1∶1的原料气充入恒容密闭容器中,初始压强为P1,反应达平衡时总压强为P2,则平衡时甲醇的转化率为___(忽略副反应)。
=1∶1的原料气充入恒容密闭容器中,初始压强为P1,反应达平衡时总压强为P2,则平衡时甲醇的转化率为___(忽略副反应)。
【答案】CH3OH(g)![]() CO(g)+2H2(g) △H=+90kJ/mol 升温 提高甲醇的利用率,有利于抑制CO的生成或抑制副反应发生 (
CO(g)+2H2(g) △H=+90kJ/mol 升温 提高甲醇的利用率,有利于抑制CO的生成或抑制副反应发生 (![]() -1)×100%
-1)×100%
【解析】
根据盖斯定律计算反应热,根据勒夏特列原理和有效碰撞理论判断平衡正向移动,且增大反应速率的措施;恒温恒容下,气体的压强之比等于其物质的量之比,计算平衡时气体的总物质的量,再利用差量法计算参加反应甲醇的物质的量,进而计算甲醇的转化率。
①甲醇蒸气在催化剂作用下裂解可得到H2和CO,根据盖斯定律,该反应的热化学方程式为CH3OH(g)![]() CO(g)+2H2(g)△H=+49kJmol-1+41kJmol-1=+90kJ/mol,正反应为气体体积增大的吸热反应,升高温度,增大反应速率,有利于平衡正向移动。
CO(g)+2H2(g)△H=+49kJmol-1+41kJmol-1=+90kJ/mol,正反应为气体体积增大的吸热反应,升高温度,增大反应速率,有利于平衡正向移动。
②适当增大水醇比![]() 有利于反应正向进行,提高甲醇的利用率,有利于抑制CO的生成。
有利于反应正向进行,提高甲醇的利用率,有利于抑制CO的生成。
③设起始n(H2O)=n(CH3OH)=1mol,恒温恒容下,气体的压强之比等于其物质的量之比,平衡时气体的总物质的量2mol×![]() ,
,
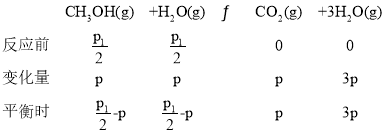
即2mol×![]() =
=![]() -p+
-p+![]() -p+p+3p,p=
-p+p+3p,p=![]() ,故甲醇的转化率为
,故甲醇的转化率为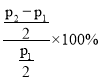 =(
=(![]() -1)×100%。
-1)×100%。


科目:高中化学 来源: 题型:
【题目】把4.48L CO2通过一定量的固体过氧化钠后收集到3. 36L气体(气体的测量均在标准状况下),则这3. 36L气体的质量是( )
A.6. 0gB.5. 6gC.4. 8gD.3. 8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种生产聚苯乙烯的流程如下:
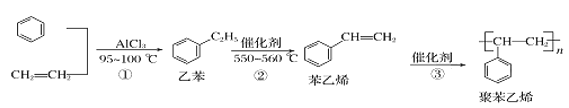
下列叙述正确的是( )
A.苯乙烯是苯的同系物
B.苯乙烯所有原子一定在同一平面内
C.反应①的反应类型是加成反应,反应②的反应类型是取代反应
D.鉴别乙苯与苯乙烯可用Br2的四氯化碳溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
_SiO2+_C+_N2![]() _Si3N4+_CO
_Si3N4+_CO
(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)该反应的氧化剂是___,其还原产物是___;
(3)该反应的平衡常数表达式为K=___;
(4)若知上述反应为放热反应,则其反应热△H___0(填“>”、“<”或“=”);升高温度,其平衡常数值___(填“增大”、“减小”或“不变”);
(5)若使压强增大,则上述平衡向___反应方向移动(填“正”或“逆”);
(6)若已知CO生成速率为v(CO)=18mol/(L·min),则N2消耗速速率为v(N2)=___mol/(L·min)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,已知有机物A的相对分子质量是28,它的产量是衡量一个国家石油化工水平的标志,B和D都是日常生活食品中常见的有机物,E是具有浓郁香味、不易溶于水的油状液体,F是一种高聚物,生活中用于制造食物保鲜膜。
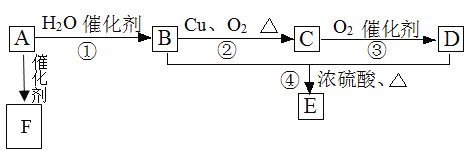
(1)请写出A的结构简式___、C的结构式___;
(2)请写出:B中官能团的电子式___、D中官能团的名称___;
(3)请写出下列反应的类型:①___,②___,④___。
(4)请写出下列物质转化的化学方程式:
A→F:___;
B→C:___;
B+D→E:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R是短周期元素,原子序数依次增大。X原子核外各层电子数之比为1∶2,Y原子和Z原子的核外电子数之和为20,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨。请回答下列问题:
(1)元素X的最高价氧化物的电子式为________;元素Z的离子结构示意图为________。
(2)单质铜和元素Y的最高价氧化物对应水化物的稀溶液发生反应的化学方程式为_______________________________________________________。
(3)元素W位于周期表的第________族,其非金属性比R弱,用原子结构的知识解释原因:_____________________________________________________________。
(4)R的一种氧化物能使品红溶液褪色,工业上用Y的气态氢化物的水溶液作该氧化物的吸收剂,写出吸收剂与足量该氧化物反应的离子方程式:__________________________________。
(5)Y和Z组成的化合物ZY,被大量用于制造电子元件。工业上用Z的氧化物、X单质和Y单质在高温下制备ZY,其中Z的氧化物和X单质的物质的量之比为1∶3,则该反应的化学方程式为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用NaI溶液中通入少量Cl2得到含碘废液,再利用含碘废液获取NaI固体,实验流程如下:

已知反应②:2I﹣+2Cu2++![]() +H2O
+H2O![]() 2CuI↓+
2CuI↓+![]() +2H+。
+2H+。
回答下列问题:
(1)过滤实验所需要的玻璃仪器有普通漏斗、烧杯、_____________。
(2)反应③中CuI被氧化,还原产物只有NO2,该反应的化学方程式为_________________。当有95.5 g CuI参与反应,则需要标况下______________L的O2才能将生成的NO2在水中完全转化为硝酸。
(3)化合物B中含两种元素,铁原子与另一种元素原子的物质的量之比为3∶8,则化合物B的化学式为_____________。
(4)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,则反应⑤的化学方程式为______。
(5)将足量的Cl2通入含12 g NaI的溶液中,一段时间后把溶液蒸干得到固体的质量为_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】张亭栋研究小组受民间中医启发,发现As2O3(俗称砒霜)对白血病有明显的治疗作用。氮(N)、磷(P)、砷(As)等都是VA族的元素,该族元素的化合物在研究和生产中有许多重要用途。回答下列问题:
(1)NH3的沸点比PH3_____(填“高"或“低”),原因是_____________。
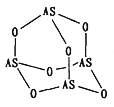
(2)Na3AsO4 中含有的化学键类型包括_______;AsO43-的空间构型为_______,As4O6的分子结构如图所示,则在该化合物中As的杂化方式是_________。
(3)自然固氮现象发生的一系列化学变化:N2→NO→NO2→HNO3→NO3-解释了民谚“雷雨发庄稼”的原理。
①NO3-中N原子采取_____杂化方式,其空间构型为________,写出它的一种等电子体的化学式________.
②已知酸性: HNO3>HNO2,下列相关见解合理的是_________.
A.含氧酸中氧原子总数越多,酸性越强
B.同种元素化合价越高,对应含氧酸的酸性越强
C.HNO3中氮元素的正电性更高,在水溶液中更易电离出H+,酸性强于HNO2
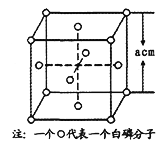
(4)白磷(P4)的晶体属于分子晶体,其晶胞结构如图(小圆圈表示白磷分子)。己知晶胞的边长为acm,阿伏加德罗常数为NA mol-1,则该晶胞中含有的P原子的个数为______,该晶体的密度为______g·cm-3(用含NA、a的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是

A. 向圆底烧瓶中滴加苯和溴的混合液前需先打开K
B. 实验中装置b中的液体逐渐变为浅红色
C. 装置c中的碳酸钠溶液的作用是吸收溴化氢
D. 反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com