
实验室中有一未知浓度的稀盐酸,某学生用0.10 mol·L-1 NaOH标准溶液进行测定盐酸的浓度的实验。取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。请完成下列填空:
|
实验编号 |
待测盐酸的体积(mL) |
NaOH溶液的浓度(mol·L-1) |
滴定完成时,NaOH溶液滴入的体积(mL) |
|
1 |
20.00 |
0.10 |
24.18 |
|
2 |
20.00 |
0.10 |
23.06 |
|
3 |
20.00 |
0.10 |
22.96 |
(1)滴定达到终点的标志是 。
(2)根据上述数据,可计算出该盐酸的浓度约为 (保留小数点后叁位)。
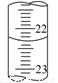
(3)若滴定结束时,碱式滴定管中的液面如图所示,终点读数为 mL。
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 。
A.用酸式滴定管取20.00 mL待测盐酸,使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥
C.称量NaOH固体时,有小部分NaOH潮解
D.滴定终点读数时俯视
E.碱式滴定管尖嘴部分有气泡,滴定后消失
(1)最后一滴NaOH溶液加入,溶液由无色恰好变成浅红色且半分钟内不褪色(2)0.115mol/L
(3)22.28至22.33均对 (4)C E
【解析】
试题分析:(1)由于指示剂酚酞在酸溶液中,所以开始溶液为无色,当滴加最后一滴NaOH溶液时,溶液由无色恰好变成浅红色且半分钟内不褪色,证明溶液恰好被中和。(2)V(NaOH)=(23.06+22.96)ml÷2=23.01ml.因为C酸·V酸=C碱·V碱。所以C酸= (C碱·V碱) ÷V酸=(0.10×23.01) ÷20.00=0.115(mol/L).(3) 在滴定结束时,碱式滴定管中的液面读数为22.28ml.(4)A. 使用前,水洗后若未用待测盐酸润洗,则标准溶液的浓度偏小,相同体积时含有的酸的物质的量偏少。消耗的碱溶液体积偏小,C酸偏低。错误。B.锥形瓶水洗后未干燥,由于酸的物质的量没变化,所以对实验结果无影响。错误。C.称量NaOH固体时,有小部分NaOH潮解,则碱的物质的量减少,使用该碱溶液测定盐酸时消耗的体积就偏大。所以测定的酸的浓度就偏高。正确。D. 滴定终点读数时俯视,则溶液的体积偏小,所测定的酸溶液浓度就偏小。错误。E.碱式滴定管尖嘴部分有气泡,滴定后消失,则溶液的体积偏大,以此为标准测定的溶液的浓度就偏大。正确。选项为C E。
考点:考查酸碱中和滴定的终点的判断、读数、误差分析等知识。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:| 实验编号 | NaOH溶液的浓度 (mol/L) |
滴定完成时,消耗NaOH溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 20.02 | 20.00 |
| 2 | 0.10 | 20.00 | 20.00 |
| 3 | 0.10 | 19.00 | 20.00 |
| 4 | 0.10 | 19.98 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:| 实验编号 | NaOH溶液的浓度 (mol/L) |
滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.1000 | 22.62 | 20.00 |
| 2 | 0.1000 | 22.72 | 20.00 |
| 3 | 0.1000 | 22.80 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | 待测盐酸的体积(mL) | 标准NaOH溶液体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 20.00 | 0.40 | 20.50 |
| 第二次 | 20.00 | 4.10 | 24.00 |
| 第三次 | 20.00 | 1.00 | 24.00 |

查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:| 实验编号 | NaOH溶液的浓度 (mol/L) |
滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
查看答案和解析>>
科目:高中化学 来源:2014届河南省高二第二次阶段考试化学试卷(解析版) 题型:实验题
(13分)实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验。请你完成下列填空:
步骤一:配制250mL 0.1000mol/L NaOH标准溶液。
步骤二:取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作4次,记录数据如下。
|
实验编号 |
NaOH溶液的浓度 (mol/L) |
滴定完成时,消耗NaOH溶液的体积(mL) |
待测盐酸溶液的体积(mL) |
|
1 |
0.10 |
20.02 |
20.00 |
|
2 |
0.10 |
20.00 |
20.00 |
|
3 |
0.10 |
19.00 |
20.00 |
|
4 |
0.10 |
19.98 |
20.00 |
(1)步骤一需要称量氢氧化钠固体的质量为__________g,配制标准溶液需要用到玻璃棒,烧杯外,还需要的玻璃仪器有_________________________________________。
(2)步骤二中量取20.00mL的稀盐酸用到的仪器是________________。滴定达到终点的现象是_______________________________________。
(3)根据上述数据,可计算出该盐酸的浓度为 。
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏高的有
A. 配制标准溶液定容时,加水超过刻度
B. 锥形瓶水洗后直接装待测液
C. 酸式滴定管水洗后未用待测稀盐酸溶液润洗
D. 滴定到达终点时,仰视读出滴定管读数;
E. 碱式滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com