
实验室利用如图中装置制取乙酸异戊酯,其合成过程为:
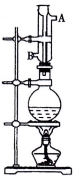
①向圆底烧瓶中加入几粒碎瓷片,并注入0.14 mol异戊醇和0.35mol冰醋酸,再加入4mL浓H2SO4至不再分层。②在烧瓶上安装冷凝回流装置,加热混合物1h后,冷却至室温。③把混合物转至分液漏斗中,加入少量蒸馏水,振荡分层后除去水层,再用蒸馏水洗涤有机层。④用5%的NaHCO3溶液分几次洗涤产品直至中性。⑤向上述溶液中加NaCl晶体,搅拌静置,对液体进行分液。⑥将粗产品转至蒸馏烧瓶中,加入碎瓷片,并加适量无水MgSO4或Mg(NO3)2,蒸馏,收集135-143℃之间的馏分。
试回答下列问题:
(1)冷凝管中冷却水的流向是由 进入,由 (均填“A”或“B”)流出。
(2)圆底烧瓶中的物质 (填“会”或“不会”)从冷凝管上口跑掉,是因为 。
(3)合成实验中浓H2SO4的作用是 。
碎瓷片的作用是 。
(4)乙酸与异戊醇的物质的量之比0.35:0.14>1:1的原因是 。
(5)在③中用蒸馏水多次洗涤的作用是 。
④中用NaHCO3溶液洗涤产品的作用是 。
(1)B;A。
(2)不会,因在冷凝管中被冷却成液体回流到圆底烧瓶中
(3)催化和吸水作用 防止液体暴沸。
(4)因反应可逆,增加一种反应物的量可提高另一种成本较高的异戊醇的转化率。
(5)洗去乙酸和硫酸,洗去可能残存的少量酸。
【解析】
试题分析:冷凝管竖直放置时,进水方向与蒸气流向一致;圆底烧瓶中的物质不会从上口跑掉,因为在冷凝管中蒸气会被冷却成液体回流到圆底烧瓶中;浓H2SO4在此反应中起催化剂和吸水作用,碎瓷片防止液体暴沸;由于酯化反应是可逆反应,增加乙酸的量可提高异戊醇的转化率;③中用蒸馏水洗涤,目的是除去乙酸和硫酸,④中洗去可能残存的少量酸。
考点:有机物的制备和分离提纯实验设计与评价。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2013-2014湖南长沙县一中、浏阳一中、宁乡一中高三5月化学试卷(解析版) 题型:选择题
下列图示与对应的叙述相符的是

A.由图甲可以判断:若T1>T2,反应A(g)+ B(g) 2C(g)的△H<0
2C(g)的△H<0
B.图乙表示压强对可逆反应2A(g)+2 B(g) 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
C.根据图丙,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量NaOH溶液,调节pH≈4
D.图丁表示用0.1mol/L的盐酸滴定20mL 0.1mol/LNaOH溶液,溶液pH随加入盐酸体积的变化
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省衡南县高二下学期期末考试化学试卷(解析版) 题型:选择题
设阿伏加德罗常数(NA)的数值为nA,下列说法正确的是( )
A.1 mol Cl2与足量Fe反应,转移的电子数为3nA
B.1.5 mol NO2与足量H2O反应,转移的电子数为1.5nA
C.常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3nA
D.0.10mol Fe粉与足量水蒸气反应生成的H2分子数为0.10nA
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省衡南县高一下学期期末考试化学试卷(解析版) 题型:选择题
在2A+2B C+5D反应中,表示该反应速率最快的是( )
C+5D反应中,表示该反应速率最快的是( )
A.v(A)=0.5 mol/(L·s) B.v(B)=0.3 mol/(L·s)
C.v(C)=0.4 mol/(L·s) D.v(D)=1 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省衡南县高一下学期期末考试化学试卷(解析版) 题型:选择题
下列各组物质中属于同分异构体的是
A.正丁烷和异丁烷 B.金刚石和石墨 C. 12 C和13 C D. 乙烯和乙烷
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省益阳市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.镁与极稀硝酸反应生成硝酸铵的离子方程式为:4Mg+6H++NO3-=4Mg2++NH4++3H2O
B.将10mL 0.1 mol/L Na2CO3溶液逐滴滴加到10 mL 0.1 mol/L盐酸中,c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-)
C.等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH4+)=c(K+)=2c(Ba2+)
D.将10mL 0.1 mol.L-1 KAl(SO4)2溶液和10 mL 0.2 mol.L-1 Ba(OH)2溶液混合,得到的沉淀中Al(OH)3和BaSO4的物质的量之比为1:2
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省益阳市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列各组中的反应属于同一反应类型的是( )
A.苯的硝化反应;乙烯使溴水褪色
B.葡萄糖与新制氢氧化铜共热;无水乙醇与浓硫酸共热制乙烯
C.乙醇和乙酸制乙酸乙酯;乙烷和氯气得到氯乙烷
D.乙醇和氧气制乙醛;苯和液溴制溴苯
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省益阳市高一上学期期末考试化学(理)试卷(解析版) 题型:选择题
已知2SO2(g)+O2(g)  2SO3(g),起始时SO2和O2分别为20mol和10mol,达到平衡时SO2的转化率为80%。若从SO3开始进行反应,在相同的条件下,欲使平衡时各成分的体积分数与前者相同,则起始时SO3的物质的量及SO3的转化率分别为
2SO3(g),起始时SO2和O2分别为20mol和10mol,达到平衡时SO2的转化率为80%。若从SO3开始进行反应,在相同的条件下,欲使平衡时各成分的体积分数与前者相同,则起始时SO3的物质的量及SO3的转化率分别为
A.10mol 10% B.20mol 20% C.20mol 40% D.30mol 80%
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省岳阳市高三教学质量检测二理综化学试卷(解析版) 题型:实验题
氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟工业原理制备氨基甲酸铵,反应的化学方程式如下:2 NH3(g)+CO2(g)  NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0
(1)实验室制备NH3的化学方程式是: 。
(2)制备氨基甲酸铵的装置如下图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
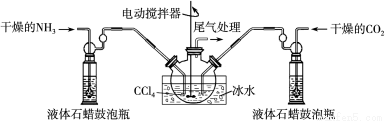
注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是 。液体石蜡鼓泡瓶的作用是 。
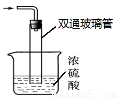 ②从反应后的混合物中分离出产品的实验方法是 (填写操作名称)。为了得到干燥产品,应采取的方法是 (填写选项序号)。
②从反应后的混合物中分离出产品的实验方法是 (填写操作名称)。为了得到干燥产品,应采取的方法是 (填写选项序号)。
a. 常压加热烘干 b. 高压加热烘干 c. 真空40 ℃以下烘干
③尾气处理装置如右图所示。双通玻璃管的作用: ;
浓硫酸的作用: 。
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7825 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000 g。则样品中氨基甲酸铵的物质的量分数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com