
【题目】下图中,A是固体金属单质,燃烧时火焰呈黄色。
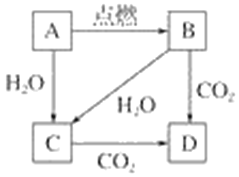
(1)写出下列符号所代表的物质的化学式:
A____________,B____________,C____________,D____________。
(2)写出下列转化的化学方程式:
①A→B________________________________________。
②B→D________________________________________。
③A→C________________________________________。
【答案】Na Na2O2 NaOH Na2CO3 2Na+O2![]() Na2O2 2Na2O2+2CO2=2Na2CO3+O2 2Na+2H2O=2NaOH+H2↑
Na2O2 2Na2O2+2CO2=2Na2CO3+O2 2Na+2H2O=2NaOH+H2↑
【解析】
(1)如图所示A是固体金属单质,燃烧时火焰呈黄色判断为Na,B为Na2O2,C为NaOH,D为Na2CO3,
(2)①A→B的反应为钠在点燃(或加热)的条件下反应生成过氧化钠;
②B→D的反应为过氧化钠和二氧化碳反应生成碳酸钠和氧气;
③A→C的反应为钠与水反应生成氢氧化钠和氢气。
(1)如图所示A是固体金属单质,燃烧时火焰呈黄色判断为Na,B为Na2O2,C为NaOH,D为Na2CO3,
故答案为:Na;Na2O2;NaOH;Na2CO3;
(2)①A→B的反应为钠点燃反应生成过氧化钠,反应的化学方程式为:2Na+O2![]() Na2O2,故答案为:2Na+O2
Na2O2,故答案为:2Na+O2![]() Na2O2,
Na2O2,
②B→D的反应为过氧化钠和二氧化碳反应生成碳酸钠和氧气,反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,
故答案为:2Na2O2+2CO2=2Na2CO3+O2;
③A→C的反应为钠与水反应生成氢氧化钠和氢气,反应的化学方程式为:2Na+2H2O=2NaOH+H2↑,
故答案为:2Na+2H2O=2NaOH+H2↑;


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案科目:高中化学 来源: 题型:
【题目】下图的各方框表示有关的一种反应物或生成物(某些物质已经略去),其中常温下A、C、D为无色气体,C能使湿润的红色石蕊试纸变蓝。

(1)写出下列各物质的化学式:
X:________;F:_______。
(2)写出下列变化的反应方程式:
A→D:____________________;
C→E:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁、高效新能源,也是重要的化工原料。
(1)工业上利用甲烷制备氢气的反应为:CH4(g)+H2O(g)![]() CO(g)+3H2(g)
CO(g)+3H2(g)
已知:
①H2(g)+![]() O2(g)=H2O(g) △H1=-198kJ/mol
O2(g)=H2O(g) △H1=-198kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H2=-576kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H3=-846.3kJ/mol
则CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H4=________。
CO(g)+3H2(g) △H4=________。
(2)工业上利用CO和H2合成清洁能源CH3OH,其反应为:CO(g)+2H2(g)![]() CH3OH(g) △H=-116kJ/mo1
CH3OH(g) △H=-116kJ/mo1
①如图表示CO的平衡转化率(α)随温度和压强变化的示意图。X表示的是_______,理由_________;Y1_____Y2 (填“<”、“=”、“>”)。
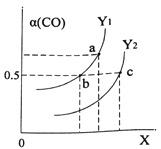
②在2L恒容密闭容器中充入2molCO和4molH2,在一定条件下经过10min达到平衡状态c 点处。则在该条件下,从开始至达到平衡状态v(CH3OH)=________,平衡常数Ka、Kb、Kc的大小关系:____________。
③下列措施既能增大反应速率又能提高反应物的转化率的是_______。
A.使用催化剂 B.及时分离CH3OH C.升高温度 D.增大压强
(3)已知燃料电池的比能量与单位质量燃料物质失去的电子数成正比。理论上H2、CH4、CH3OH的碱性电池的比能量由小到大的顺序为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 澄清石灰水与过量碳酸氢钠溶液反应:![]() +Ca2++OH﹣=CaCO3↓+H2O
+Ca2++OH﹣=CaCO3↓+H2O
B. 硫酸氢钠溶液中加入氢氧化钡溶液至中性:H++![]() +Ba2++OH﹣=BaSO4↓+2H2O
+Ba2++OH﹣=BaSO4↓+2H2O
C. 向氢氧化钠溶液中通入足量CO2:2OH﹣+CO2=![]() +H2O
+H2O
D. 向氢氧化钡溶液中加入过量硫酸:2H++![]() +Ba2++2OH﹣=BaSO4↓+2H2O
+Ba2++2OH﹣=BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纤维素被称为第七营养素.食物中的纤维素虽然不能为人体提供能量,但能促进肠道蠕动、吸附排出有害物质.从纤维素的化学成分看,它是一种
A. 二糖 B. 多糖 C. 氨基酸 D. 脂肪
查看答案和解析>>
科目:高中化学 来源: 题型:
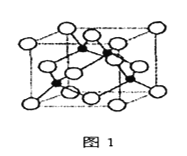
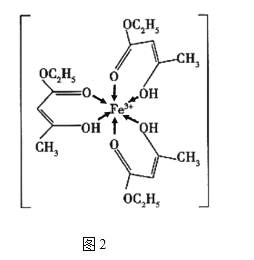
【题目】金属铁、铜及其化合物在科学研究和工业生产中具有重要的用途。下图1表示铜与氯形成化合物A的晶胞(黑球代表铜原子)。图2是Fe3+与乙酰乙酸乙酯形成的配离子B。
回答下列问题
(1)基态Cu原子的核外电子排布式为____________________________。
(2)从原子结构角度分析,第一电离能I1(Fe)与I1(Cu)的关系是:I1(Fe)________I1(Cu)(填“>“<”或“=”)
(3)化合物A的化学式为____________,Cl原子的配位数是____________。
(4)B中碳原子的杂化轨道类型为________,含有的化学键为________(填字母)。
a.离子键 b.金属键 c.极性键 d.非极性键
e.配位键 f.氢键 g.σ键 h.π键
(5)化合物A难溶于水,但易溶于氨水,其原因可能是________________;与NH3互为等电子体的分子有________________(写化学式,一种即可)。NH3的键角大于H2O的键角的主要原因是________________________________________。
(6)已知化合物A晶体的密度为ρg·cm-3,阿伏加德罗常数的值为NA,则该晶体中两个Cu原子之间的最短距离为________________________nm(列出计算表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
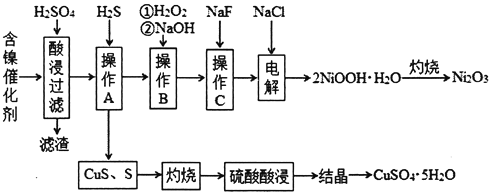
【题目】某科研小组以废旧的含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)为原料制取Ni2O3,工艺流程如下图:
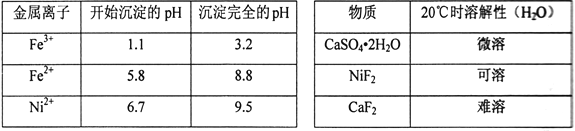
相关离子生成氢氧化物的pH和相关物质的溶解性如下表:
回答下列问题:
(1)滤渣的主要成分为BaSO4和____________________(填化学式)。
(2)操作A中发生反应的离子方程式为Cu2++H2S=CuS↓+2H+、_________________________;操作A中没有FeS和NiS沉淀产生,其原因是(用Ka和Ksp解释)__________________________。
(3)操作B加入H2O2的目的是________________,加NaOH溶液调节pH应在____________范围内;操作C中加入NaF的目的是____________________。
(4)该工艺流程中使用H2S气体,优点是可以制取副产品CuSO4·5H2O,但也有明显的缺点:一是产生空气污染,二是______________________________________________。
(5)电解产生2NiOOH·H2O的原理为:在碱性条件下电解,Cl-在阳极被氧化为ClO-,ClO-再将Ni2+氧化成2NiOOH·H2O沉淀。则阳极的电极反应式为________________________。
(6)0.80g CuSO4·5H2O副产品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示,CuSO4·5H2O稳定存在的温度应低于________,则200℃时固体物质的化学式____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是高中化学常用的物理量,请完成以下有关计算:
(1)0. 6 g H2中含有氢原子数为_________。
(2)标准状况下,含有相同氧原子数的CO和CO2的体积之比为____________。
(3)100mL硫酸钠溶液中n(Na+)=0.2mol,则其中c(SO42-)=_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,配制一组c(H2CO3)+c(HCO3-)+c(CO32-)=1.000×10-3mol·L-1的H2CO3与HCl或H2CO3与NaOH的混合溶液,溶液中部分微粒浓度的负对数(-lgc)与pH关系如下图所示。下列说法正确的是( )
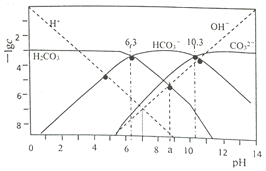
A. pH=6.3的溶液中:c(Na+)>1.000×10-3mol·L-1
B. pH=7的溶液中:c(Na+)>c(H2CO3)>c(CO32-)
C. pH=a的溶液中:c(HCO3-)>c(Na+)>c(H+)>c(CO32-)
D. 25℃时,反应H2CO3+CO32-![]() 2HCO3-的平衡常数为1.0×104
2HCO3-的平衡常数为1.0×104
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com