
【题目】t℃时,配制一组c(H2CO3)+c(HCO3-)+c(CO32-)=1.000×10-3mol·L-1的H2CO3与HCl或H2CO3与NaOH的混合溶液,溶液中部分微粒浓度的负对数(-lgc)与pH关系如下图所示。下列说法正确的是( )
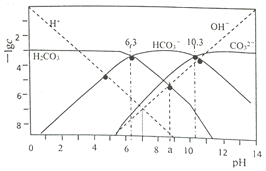
A. pH=6.3的溶液中:c(Na+)>1.000×10-3mol·L-1
B. pH=7的溶液中:c(Na+)>c(H2CO3)>c(CO32-)
C. pH=a的溶液中:c(HCO3-)>c(Na+)>c(H+)>c(CO32-)
D. 25℃时,反应H2CO3+CO32-![]() 2HCO3-的平衡常数为1.0×104
2HCO3-的平衡常数为1.0×104
【答案】BD
【解析】A. pH=6.3的溶液中碳酸略过量:c(H2CO3)+c(HCO3-)+c(CO32-)=1.000×10-3mol·L-1, 故c(Na+)>1.000×10-3mol·L-1,选项A错误;B. pH=7的溶液中:由电荷守恒有c(Na+)+ c(H+)= c(HCO3-)+ 2c(CO32-)+ c(OH-),则c(Na+)> c(CO32-),由图可知c(H2CO3)>c(CO32-),故c(Na+)>c(H2CO3)>c(CO32-),选项B正确;C. pH=a的溶液中,由图中信息可知, c(CO32-)>c(H+),选项C错误;D. 25℃时,pH=6.3时,c(H2CO3)= c(HCO3-),K1=c(H+)=10-6.3,pH=10.3时,c(CO32-)= c(HCO3-),K2=c(H+)=10-10.3,反应H2CO3+CO32-![]() 2HCO3-的平衡常数K=
2HCO3-的平衡常数K=![]() =
=![]() =
=![]() =
=![]() =1.0×104,选项D正确。答案选BD。
=1.0×104,选项D正确。答案选BD。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下图中,A是固体金属单质,燃烧时火焰呈黄色。
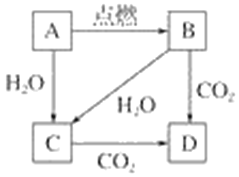
(1)写出下列符号所代表的物质的化学式:
A____________,B____________,C____________,D____________。
(2)写出下列转化的化学方程式:
①A→B________________________________________。
②B→D________________________________________。
③A→C________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学链燃烧技术是目前能源领域研究的热点之一,用NiO作载氧体的化学链燃烧示意图和相关热化学反应如下:
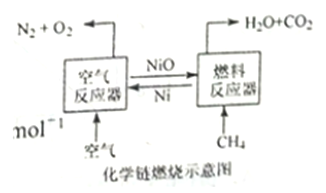
2Ni(s)+O2(g)=2NiO(s)△H=-479.8 kJ·mol-1
CH4(g)+NiO(s)=CO(g)+2H2(g)+Ni(s)△H=akJ·mol-1
CH4(g)+2NiO(s)=CO2(g)+2H2(g)+2Ni(S)△H=b kJ·mol-1
CH4(g)+4NiO(s)=CO2(g)+2H2O(g)+4Ni(s)△H=156.9 kJ·mol-1
下列说法错误的是( )
A. CO2(g)+CH4(g)=2CO(g)+2H2(g) △H=(2a-b) kJ·mol-1
B. CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.7 kJ·mol-1
C. 甲烷在“燃料反应器”中反应时产生淡蓝色火焰并放出热量
D. 含碳燃料利用“化学链燃烧技术”有利于二氧化碳的分离与回收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg·mol-1。若阿伏伽德罗常数用NA表示,则
(1)该气体的物质的量为 mol。
(2)该气体所含原子总数为 个。
(3)该气体在标准状况下的体积为 L。
(4)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,氯离子浓度最大的是
A. 200mL 1molL-1NaCl溶液 B. 50mL 1.5molL-1AlCl3溶液
C. 100mL 0.8molL-1MgCl2溶液 D. 200mL 2molL-1KCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】托特罗定(G)是毒蕈碱受体拮抗剂,其一种合成路线流程图如下:

(1)C中含氧官能团名称为__________和__________。
(2)D生成E的反应类型为__________。
(3)化合物X的分子式为C9H8O2,写出X的结构简式:__________。
(4)写出同时满足下列条件的C的一种同分异构体的结构简式:__________。
能发生水解反应,两种水解产物均能与FeCl3溶液发生显色反应且分子中均只有4种不同化学环境的氢。
(5)已知:R1-CHO![]()
![]() (R1、R2代表烃基或H)
(R1、R2代表烃基或H)
请写出以![]() 、CH3CHO和(CH3)2SO4为原料制备
、CH3CHO和(CH3)2SO4为原料制备![]() 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。______________________
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向500 mL NaOH溶液中投入10.8 g Al,二者恰好完全反应,请计算:
(1)Al的物质的量。
(2)参加反应的NaOH的物质的量和原溶液中溶质的物质的量浓度。
(3)在标准状况下生成H2的体积。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列组合属于同素异形体的是
A. 3517Cl与3717Cl B. 金刚石与C60
C. CH3CH2CH2CH3和(CH3)2CHCH3 D. CH3CH3与CH3CH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨厂和硝酸厂的烟气中含有大量的氮氧化物(NOx),脱硝通常是指将烟气中的氮氧化物转化为无毒无害的物质的化学过程。
(1)选择性催化还原技术(SCR)是目前最成熟的脱硝技术,即在金属催化剂的作用下,用还原剂(如NH3)选择性的与NOx反应生成N2和H2O。
已知:4NH3(g)+5O2(g)4NO(g)+6H2O(g)△H=-905.5kJmol-1
N2(g)+O2(g)2NO(g) △H=+180kJmol-1
脱硝反应:4NH3(g)+6NO(g)5N2(g)+6H2O(g)的△H=_______kJmol-1
(2)将amolN2和3amolH2通入一密闭容器中在不同的温度和压强下发生反应:N2(g)+3H2(g)2NH3(g)。测得平衡体系中NH3的物质的量的分数如图所示。
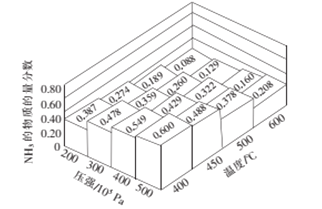
①下列可提高氨气产率的途径是__________。
A.尽量提高反应温度 B.对原料气适当加压
C.采用适当的催化剂 D.将氨气液化,不断移出液氨
②上图所示平衡体系中当NH3的物质的量分数分别为0.549和0.429时,该反应的平衡常数分别为K1和K2,则K1________K2(填写“>”,“<”或“=”)。当NH3的物质的量分数为0.600时,容器的体积为2L,此时该反应的化学平衡常数K=________。
(3)常温下,将NO和H2的混合气体通入Ce(SO4)2与Ce2(SO4)3的混合溶液中其物质转化过程如图所示,
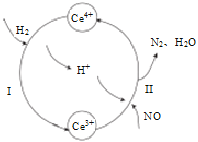
①反应I中氧化剂与还原剂的物质的量之比为_______。
②写出该过程的总化学反应方程式_____________________________________。
(4)直接电解吸收也是脱硝的一种方法,先用6%的稀硝酸吸收NOx,会生成HNO2(一种一元弱酸),再将吸收液导入电解槽中进行电解,使之转化为硝酸,其电解装置如图所示。
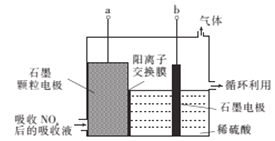
①图中b应连接电源的_______(“正极”或“负极”)。
②阳极的电极反应式为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com