
【题目】化学链燃烧技术是目前能源领域研究的热点之一,用NiO作载氧体的化学链燃烧示意图和相关热化学反应如下:
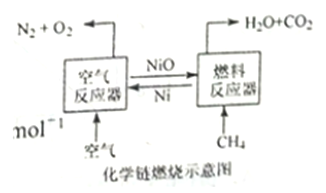
2Ni(s)+O2(g)=2NiO(s)△H=-479.8 kJ·mol-1
CH4(g)+NiO(s)=CO(g)+2H2(g)+Ni(s)△H=akJ·mol-1
CH4(g)+2NiO(s)=CO2(g)+2H2(g)+2Ni(S)△H=b kJ·mol-1
CH4(g)+4NiO(s)=CO2(g)+2H2O(g)+4Ni(s)△H=156.9 kJ·mol-1
下列说法错误的是( )
A. CO2(g)+CH4(g)=2CO(g)+2H2(g) △H=(2a-b) kJ·mol-1
B. CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.7 kJ·mol-1
C. 甲烷在“燃料反应器”中反应时产生淡蓝色火焰并放出热量
D. 含碳燃料利用“化学链燃烧技术”有利于二氧化碳的分离与回收
【答案】C
【解析】已知:①2Ni(s)+O2(g)=2NiO(s)△H1=-479.8 kJ·mol-1
②CH4(g)+NiO(s)=CO(g)+2H2(g)+Ni(s)△H2=akJ·mol-1
③CH4(g)+2NiO(s)=CO2(g)+2H2(g)+2Ni(S)△H3=b kJ·mol-1
④CH4(g)+4NiO(s)=CO2(g)+2H2O(g)+4Ni(s)△H4=+156.9 kJ·mol-1
A. 根据盖斯定律,由②![]() ③得反应CO2(g)+CH4(g)=2CO(g)+2H2(g) △H=(2a-b) kJ·mol-1,选项A正确;B. 根据盖斯定律,由①
③得反应CO2(g)+CH4(g)=2CO(g)+2H2(g) △H=(2a-b) kJ·mol-1,选项A正确;B. 根据盖斯定律,由①![]() ④得反应CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.7 kJ·mol-1,选项B正确;C. 甲烷在“燃料反应器”中反应时不是甲烷的燃烧反应,不产生淡蓝色火焰,选项C错误;D. 含碳燃料利用“化学链燃烧技术”有利于二氧化碳的分离与回收,选项D正确。答案选C。
④得反应CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.7 kJ·mol-1,选项B正确;C. 甲烷在“燃料反应器”中反应时不是甲烷的燃烧反应,不产生淡蓝色火焰,选项C错误;D. 含碳燃料利用“化学链燃烧技术”有利于二氧化碳的分离与回收,选项D正确。答案选C。


科目:高中化学 来源: 题型:
【题目】氢气是一种清洁、高效新能源,也是重要的化工原料。
(1)工业上利用甲烷制备氢气的反应为:CH4(g)+H2O(g)![]() CO(g)+3H2(g)
CO(g)+3H2(g)
已知:
①H2(g)+![]() O2(g)=H2O(g) △H1=-198kJ/mol
O2(g)=H2O(g) △H1=-198kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H2=-576kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H3=-846.3kJ/mol
则CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H4=________。
CO(g)+3H2(g) △H4=________。
(2)工业上利用CO和H2合成清洁能源CH3OH,其反应为:CO(g)+2H2(g)![]() CH3OH(g) △H=-116kJ/mo1
CH3OH(g) △H=-116kJ/mo1
①如图表示CO的平衡转化率(α)随温度和压强变化的示意图。X表示的是_______,理由_________;Y1_____Y2 (填“<”、“=”、“>”)。
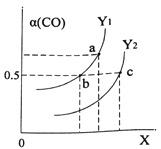
②在2L恒容密闭容器中充入2molCO和4molH2,在一定条件下经过10min达到平衡状态c 点处。则在该条件下,从开始至达到平衡状态v(CH3OH)=________,平衡常数Ka、Kb、Kc的大小关系:____________。
③下列措施既能增大反应速率又能提高反应物的转化率的是_______。
A.使用催化剂 B.及时分离CH3OH C.升高温度 D.增大压强
(3)已知燃料电池的比能量与单位质量燃料物质失去的电子数成正比。理论上H2、CH4、CH3OH的碱性电池的比能量由小到大的顺序为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
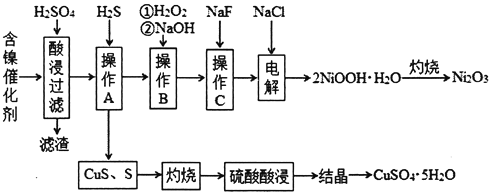
【题目】某科研小组以废旧的含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)为原料制取Ni2O3,工艺流程如下图:
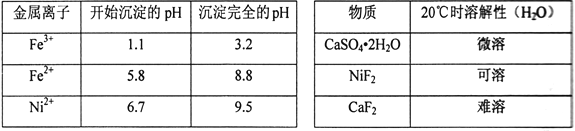
相关离子生成氢氧化物的pH和相关物质的溶解性如下表:
回答下列问题:
(1)滤渣的主要成分为BaSO4和____________________(填化学式)。
(2)操作A中发生反应的离子方程式为Cu2++H2S=CuS↓+2H+、_________________________;操作A中没有FeS和NiS沉淀产生,其原因是(用Ka和Ksp解释)__________________________。
(3)操作B加入H2O2的目的是________________,加NaOH溶液调节pH应在____________范围内;操作C中加入NaF的目的是____________________。
(4)该工艺流程中使用H2S气体,优点是可以制取副产品CuSO4·5H2O,但也有明显的缺点:一是产生空气污染,二是______________________________________________。
(5)电解产生2NiOOH·H2O的原理为:在碱性条件下电解,Cl-在阳极被氧化为ClO-,ClO-再将Ni2+氧化成2NiOOH·H2O沉淀。则阳极的电极反应式为________________________。
(6)0.80g CuSO4·5H2O副产品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示,CuSO4·5H2O稳定存在的温度应低于________,则200℃时固体物质的化学式____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是高中化学常用的物理量,请完成以下有关计算:
(1)0. 6 g H2中含有氢原子数为_________。
(2)标准状况下,含有相同氧原子数的CO和CO2的体积之比为____________。
(3)100mL硫酸钠溶液中n(Na+)=0.2mol,则其中c(SO42-)=_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在规定范围内使用食品添加剂,一般认为对人体健康无害,如果违反规定,均会损害人体健康。下列物质可用作食品防腐剂的是
A. 甲醛 B. 维生素E C. 柠檬酸 D. 苯甲酸及其钠盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于离子共存或离子反应的说法正确的是 ( )
A. 某无色溶液中可能大量存在H+、Cl-、MnO、K+
B. 使红色石蕊试纸变蓝的溶液中,H+、Al3+、Cl-、NO3-
C. Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+===2Fe3++2H2O
D. 稀硫酸与Ba(OH)2溶液的反应:H++SO![]() +Ba2++OH-===BaSO4↓+H2O
+Ba2++OH-===BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在元素周期表中,元素A、B位于同周期,A在ⅡA族,B在ⅢA族。A的原子序数为a,B的原子序数为b,不可能是( )
A.b=a+1B.b=a+11
C.b=a+10D.b=a+25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,配制一组c(H2CO3)+c(HCO3-)+c(CO32-)=1.000×10-3mol·L-1的H2CO3与HCl或H2CO3与NaOH的混合溶液,溶液中部分微粒浓度的负对数(-lgc)与pH关系如下图所示。下列说法正确的是( )
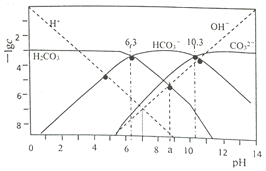
A. pH=6.3的溶液中:c(Na+)>1.000×10-3mol·L-1
B. pH=7的溶液中:c(Na+)>c(H2CO3)>c(CO32-)
C. pH=a的溶液中:c(HCO3-)>c(Na+)>c(H+)>c(CO32-)
D. 25℃时,反应H2CO3+CO32-![]() 2HCO3-的平衡常数为1.0×104
2HCO3-的平衡常数为1.0×104
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl2是一种常用的还原剂。实验室用无水氯化铁和氯苯来制备无水FeCl2。反应原理:2FeCl3+C6H5Cl![]() 2FeCl2+C6H4Cl2+HCl
2FeCl2+C6H4Cl2+HCl
熔点(℃) | 沸点(℃) | 溶解性(水) | 溶解性 (乙醇) | 溶解性 (乙醚) | 其它 | |
FeCl3、FeCl2 | 易吸水 | 易溶 | 不溶 | 不溶于C6H5Cl 、C6H4Cl2 | ||
C6H5Cl | 45 | 132 | 不溶 | 易溶 | 易溶 | |
C6H4Cl2 | 53 | 173 | 不溶 | 易溶 | 易溶 |
现设计如下方案:在A中放入16.25 g无水氯化铁和过量的氯苯,控制反应温度在128-139℃加热3 h.冷却、分离提纯得到粗产品;烧杯中所得盐酸(假设HCl完全被吸收)用AgNO3溶液滴定以测氯化铁转化率。
请回答下列问题:

(1)仪器B的名称__________
(2)仪器C中盛装的试剂可以是_______
A.无水氯化钙 B.碱石灰 C.五氧化二磷 D.浓统酸
(3)反应后通入N2的目的是___________
(4)已知20![]() :时Ksp(AgCl,白色)=1.8×10-10,Ksp(Ag2CrO4,砖红色)=3.4×10-11.
:时Ksp(AgCl,白色)=1.8×10-10,Ksp(Ag2CrO4,砖红色)=3.4×10-11.
将烧杯内溶液稀释至100 mL,每次取25.00 mL溶液进行滴定。选用K2CrO4做指示剂,用0.1000mol/L的硝酸银标准溶液滴定,三次滴定消耗标准溶液的平均体积为25.20 mL,则滴定终点的现象是______,氯化佚的转化率是______________
(5)冷却实验装置,将三颈烧瓶内物质经过过滤、洗涤、干燥后,得到粗产品,洗涤所用最佳试剂是____;回收滤液中C6H5Cl的操作方法是_____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com