
【题目】液态金属储能电池是一类成本较低的储能电池,其主体结构由三层密度不同的液体构成,上下两层液态金属分别作为电池两极,中间层的熔融盐在充放电过程中组成均保持不变。某种液态金属储能电池的结构如图所示,下列说法错误的是( )

A. 该电池放电过程中钠电极发生氧化反应
B. 该电池充电时锌电极发生的反应是Zn-2e-=Zn2+
C. 该电池的缺点是需要较高的工作温度
D. 该电池充电时电子由电源的负极经导线移向钠电极
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图所示,ΔH1=393.5 kJ·mol1,ΔH2=395.4 kJ·mol1,下列有关说法或表示式正确的是( )

A. C(s,石墨) = C(s,金刚石) ΔH=1.9 kJ·mol1
B. 石墨和金刚石的转化是物理变化
C. 金刚石的稳定性比石墨的弱
D. 1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是
A.乙烯与溴水的反应:CH2=CH2+Br2→CH2CH2Br2
B.铜与稀硝酸反应:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
C.碳铵与盐酸反应:HCO3-+H+=CO2↑+H2O
D.聚丙烯的合成:nCH2=CHCH3![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S2O3是一种弱酸,实验室欲用0.01 mol·L-1的Na2S2O3溶液滴定I2溶液,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6,下列说法合理的是
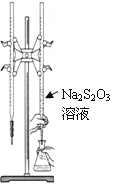
A. 该滴定可用甲基橙做指示剂
B. Na2S2O3是该反应的还原剂
C. 该滴定可选用右图所示装置
D. 该反应中每消耗2mol Na2S2O3,电子转移数为4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO2)2,其部分工艺流程如下:

(1)上述工艺中采用气液逆流接触吸收(尾气从吸收塔底部进入,石灰乳从吸收塔顶部喷淋),其目的是______________________________;滤渣可循环利用,滤渣的主要成分是____________(填化学式)。
(2)该工艺需控制NO和NO2物质的量之比接近1∶1。
若排放的尾气中NO含量升高,则NO和NO2物质的量之比______;若产品Ca(NO2)2中Ca(NO3)3含量升高,则NO和NO2物质的量之比_______。(填写序号)
①=1∶1 ②>1∶1 ③<1∶1 ④无法判断
(3)生产中溶液需保持弱碱性,在酸性溶液中Ca(NO2)2会发生分解,产物之一是NO,据此信息,某同学所写的反应离子方程式为2NO2-+2H+=NO2+NO↑+H2O,你同意吗?_________(填“同意”或“不同意“),如不同意,请说明你的理由________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
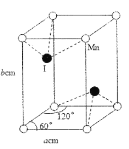
【题目】三乙酸锰可作单电子氧化剂,用如下反应可以制取三乙酸锰:4Mn(NO3)2·6H2O+26(CH3CO)2O=4(CH3COO)3Mn+8HNO2+3O2↑+40CH3COOH。
(1)基态锰原子的价层电子排布式为____,其原子核外有_____种不同运动状态的电子,基态Mn3+含有的未成对电子数是_____。
(2)CH3COOH中碳原子的杂化形式为___。CH3COOH能与H2O以任意比互溶的原因是____。
(3)NO3-的空间构型是__,与NO3-互为等电子体的分子的化学式是____(任写一种)。
(4)碘与锰形成的某种化合物晶胞结构及参数如图所示,该化合物的化学式是___,晶胞密度p为___gcm3。伏伽德罗常数的数值用NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 一定条件下反应N2+3H2![]() 2NH3,达到平衡时,3v正(H2)=2v正(NH3)
2NH3,达到平衡时,3v正(H2)=2v正(NH3)
B. 25℃时,0.1 mol/L的NaHB溶液呈酸性,说明H2B为强酸
C. 将pH=a+1的氨水稀释为pH=a的过程中,c(OH-)/c(NH3H2O)变小
D. 10mL浓度为1mol/L的盐酸与过量的Zn粉反应,若加入适量的CH3COONa溶液,既能降低反应速率,又不影响H2的生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,发生可逆反应:4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述中,不能作为此可逆反应已经达到化学平衡状态的标志的是
4NO(g)+6H2O(g),下列叙述中,不能作为此可逆反应已经达到化学平衡状态的标志的是
A.NH3的消耗速率等于NO的生成速率
B.NH3的消耗速率等于NO的消耗速率
C.NH3的浓度和NO的浓度都不发生改变
D.密闭容器内的压强不发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管中开始放入几小块镁片,再滴入5mL稀盐酸。
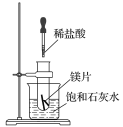
回答下列问题:
(1)实验中观察到的现象是________________。
(2)产生上述现象的原因是________________。
(3)写出有关反应的离子方程式____________。
(4)由实验推知,MgCl2溶液和H2的总能量________(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com