
【题目】海洋是一个巨大的化学资源宝库.海水综合利用的部分流程如下: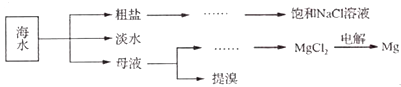
已知:Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性.
(1)电解饱和NaCl溶液的离子方程式为 , 粗盐中常含Ca2+、Mg2+、SO42﹣等杂质离子,可依次加入NaOH溶液、、、稀盐酸来进行提纯.
(2)下列方法可用于海水淡化的是(填字母)
A.蒸馏法
B.萃取法
C.过滤法
(3)工业上用电解法制Mg时,通常在MgCl3中加入CaCl2 , 其原因是:①增加电解质的密度,便于分离出熔融的镁:②
(4)用母液(含Na+、K+、Mg2+、C1﹣、Br﹣等离子)提取溴,其生产流程如下: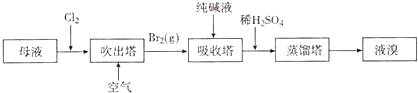
①若吸收塔中的溶液含BrO3﹣ , 则吸收塔中反应的离子方程式为 .
②母液中通入Cl2已获得含溴的溶液,为何还需经过吹出、吸收、酸化来重新获得含Br2的溶液 .
③向蒸馏塔中通人水蒸气加热,控制温度在90℃左右进行蒸馏的原因是
【答案】
(1)2Cl﹣+2H2O ![]() H2↑+Cl2↑+2OH﹣;BaCl2;Na2CO3
H2↑+Cl2↑+2OH﹣;BaCl2;Na2CO3
(2)A
(3)使氯化镁熔融温度降低,从而减少冶炼过程中的能量消耗
(4)3CO32﹣+3Br2=5Br﹣+BrO3﹣+3CO2↑;富集溴,提高Br2的浓度;温度过低难以将Br2蒸发出来,但温度过高又会将大量的水蒸馏出来
【解析】解:(1)惰性电极电解NaCl溶液,阳极上是氯离子失电子,2Cl﹣﹣2e﹣=Cl2↑,阴极上是氢离子得电子,2H++2e﹣=H2↑,由两极上的电极反应可以得到总反应为2Cl﹣+2H2O ![]() H2↑+Cl2↑+2OH﹣ , 钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,则试剂可依次加入NaOH、BaCl2、Na2CO3、HCl,
H2↑+Cl2↑+2OH﹣ , 钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,则试剂可依次加入NaOH、BaCl2、Na2CO3、HCl,
所以答案是:2Cl﹣+2H2O ![]() H2↑+Cl2↑+2OH﹣;BaCl2;Na2CO3;
H2↑+Cl2↑+2OH﹣;BaCl2;Na2CO3;
(2.)A.蒸馏法,是把水从水的混合物中分离出来,得到纯净的水,故A正确;
B.萃取法,对于微溶于水的有机物,可用萃取法,水中没有微溶于水的有机物,故B错误;
C.过滤是分离固体和溶液的操作,不能淡化水,故C错误
所以答案是:A;
(3.)离子浓度越大其熔融盐的导电性越强,在MgCl2中加入CaCl2 , 进行电解,增大离子浓度,从而增大熔融盐的导电性,使氯化镁熔融温度降低,从而减少冶炼过程中的能量消耗,
所以答案是:使氯化镁熔融温度降低,从而减少冶炼过程中的能量消耗;
(4.)由流程可知,①中发生2Br﹣+Cl2=2Cl﹣+Br2 , 利用空气将吹出塔中含Br2的溶液,经过吹出、吸收、酸化来重新获得含Br2的溶液,其目的是富集溴,提高Br2的浓度,在吸收塔中的溶液含BrO3﹣ , 可知发生3CO32﹣+3Br2=5Br﹣+BrO3﹣+3CO2↑,③中发生5Br﹣+BrO3﹣+6H+=3Br2+3H2O,最后利用蒸馏得到溴,
①纯碱是碳酸钠,与溴反应有BrO3﹣生成,反应的离子方程式为3CO32﹣+3Br2=5Br﹣+BrO3﹣+3CO2↑,
所以答案是:3CO32﹣+3Br2=5Br﹣+BrO3﹣+3CO2↑;
②从①出来的溶液中溴的含量不高,如果直接蒸馏,得到产品成本高,所以经过吹出、吸收、酸化来重新获得含Br2的溶液,其目的为富集溴,提高Br2的浓度,
所以答案是:富集溴,提高Br2的浓度;
③温度过高水蒸气蒸出,溴中含有水分,温度过低溴不能完全蒸出,产率低,所以控制温度在90℃左右进行蒸馏,
所以答案是:温度过低难以将Br2蒸发出来,但温度过高又会将大量的水蒸馏出来.


科目:高中化学 来源: 题型:
【题目】下列物质的分离方法不正确的是( )
A.用重结晶的方法除去硝酸钾中混有少量的氯化钾
B.用蒸馏的方法将自来水制成蒸馏水
C.用酒精萃取碘水中的碘
D.用过滤的方法除去食盐溶液中的泥沙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组开展下列突验探究活动 
(1)装置A中反应的化学方程式为
(2)设计实验:利用装置1中产生的气体证明+4价硫具有氧化性
(3)选用下面的装置和药品探究亚硫酸与次氯酸的酸性强弱 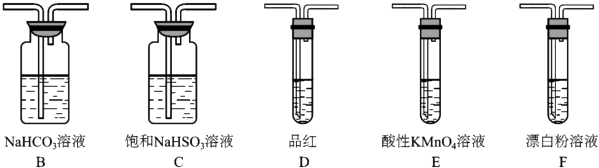
装置连接顺序为A,C, , , D,F,其中装置C的作用是 , 通过现象即可证明亚硫酸的酸性强于次氯酸
(4)利用G装置可测定装置A残液中SO2的含量,量取1.00mL残夜于烧瓶中,加适量的水稀释,加热使SO2全部溢出并与锥形瓶中H2O2完全反应SO2+H2O2=H2SO4然后用0.1000mol/L﹣1NaOH标准溶液进行滴定,至终点时消耗NaOH溶液20.00mL. ①图G中球形冷凝管进水口为(填“a”或“b”)
②残液中SO2含量为g.L﹣1
③经过多次测定发现,测定值始终高于实际值,则其原因是 . 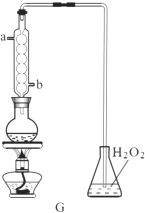
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法不正确的是( ) ![]()
A.若甲既能与盐酸反应又能与NaOH溶液反应,则丙可能属于两性氧化物
B.若丙、丁混合产生白烟,且丙为18电子分子,则乙的水溶液可能具有漂白作用
C.若甲、丙、戊含有同一种元素,该元素的化合价由低到高的顺序可能为甲<丙<戊
D.若甲为短周期中原子半径最大的主族元素的单质,且戊为碱,则丙只能为Na2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知,I2(aq)+I﹣(aq)I3﹣(aq).某I2、KI溶液中,c(I3﹣)与温度(T)的关系如图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( ) 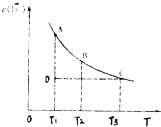
A.反应I2(aq)+I﹣(aq)I3﹣(aq)△H>0
B.状态A的c (I2)比状态D的小
C.A点对应的反应速率大于C点对应的反应速率
D.其他条件不变,向溶液中加入KI固体,平衡由C点移动到D点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项中的物质与其特征反应对应正确的是
选项 | 物质 | 特征反应 |
A | 油脂 | 遇浓硝酸变黄 |
B | 蛋白质 | 碱性条件下发生水解反应 |
C | 淀粉 | 常温下,遇碘化钾溶液变蓝 |
D | 葡萄糖 | 加热条件下,与新制Cu(OH)2反应生成砖红色沉淀 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铍(Be)与铝的性质相似.则下列判断正确的是( )
A.铍遇冷水剧烈反应
B.氧化铍的化学式为Be2O3
C.氢氧化铍能与氢氧化钠溶液反应
D.氯化铍水溶液显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高中化学《化学反应原理》选修模块从不同的视角对化学反应进行了探究、分析.以下观点中不正确的是( )
①放热反应在常温下均能自发进行;
②电解过程中,化学能转化为电能而“储存”起来;
③原电池工作时所发生的反应一定有氧化还原反应;
④加热时,化学反应只向吸热反应方向进行;
⑤盐类均能发生水解反应;
⑥化学平衡常数的表达式与化学反应方程式的书写无关.
A.①②④⑤
B.①④⑤⑥
C.②③⑤⑥
D.①②④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com