
【题目】下列选项中的物质与其特征反应对应正确的是
选项 | 物质 | 特征反应 |
A | 油脂 | 遇浓硝酸变黄 |
B | 蛋白质 | 碱性条件下发生水解反应 |
C | 淀粉 | 常温下,遇碘化钾溶液变蓝 |
D | 葡萄糖 | 加热条件下,与新制Cu(OH)2反应生成砖红色沉淀 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】能用铝作原料来冶炼难熔的金属是因为( )
A.铝的密度小,熔点较低
B.铝在空气中燃烧放出大量的热
C.铝在金属活动性顺序表中排在较前面
D.铝具有还原性,发生铝热反应时放出大量热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在生产生活中有广泛应用.
(1)已知:CO可将部分氮的氧化物还原为N2 . 反应Ⅰ:2CO(g)+2NO(g)N2(g)+2CO2(g)△H=﹣746kJmol﹣1
反应Ⅱ:4CO(g)+2NO2(g)N2(g)+4CO2(g)△H=﹣1200kJmol﹣1
写出CO将NO2还原为NO的热化学方程式 .
(2)在密闭容器中充入5mol CO和4mol NO,发生上述反应I,图1为平衡时NO的体积分数与温度、压强的关系. 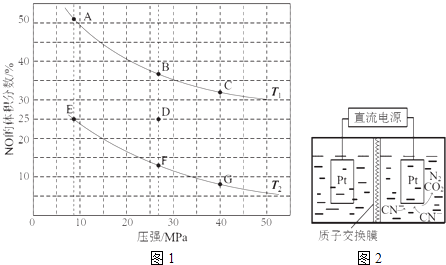
回答下列问题:
①温度:T1T2(填“<”或“>”).
②某温度下,在体积为2L的密闭容器中,反应进行10分钟放出热量373kJ,用CO的浓度变化表示的平均反应速率v(CO)= .
③某温度下,反应达到平衡状态D点时,容器体积为2L,此时的平衡常数K=(结果精确到0.01);若在D点对反应容器升温的同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中A~G点中的点
(3)某温度时,亚硝酸银AgNO2的 Ksp=9.0×10﹣4、Ag2SO4的Ksp=4.0×10﹣5 , 当向含NO2﹣、SO42﹣混合溶液中加入AgNO3溶液至SO42﹣恰好完全沉淀(即SO42﹣浓度等于1.0×10﹣5 molL﹣1)时,c(NO2﹣)= .
(4)如图2,在酸性条件下,电解水中CN﹣可转化为CO2和N2 , 请写出阳极的电极反应式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是一个巨大的化学资源宝库.海水综合利用的部分流程如下: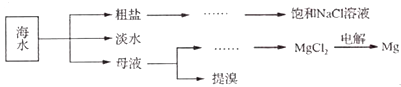
已知:Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性.
(1)电解饱和NaCl溶液的离子方程式为 , 粗盐中常含Ca2+、Mg2+、SO42﹣等杂质离子,可依次加入NaOH溶液、、、稀盐酸来进行提纯.
(2)下列方法可用于海水淡化的是(填字母)
A.蒸馏法
B.萃取法
C.过滤法
(3)工业上用电解法制Mg时,通常在MgCl3中加入CaCl2 , 其原因是:①增加电解质的密度,便于分离出熔融的镁:②
(4)用母液(含Na+、K+、Mg2+、C1﹣、Br﹣等离子)提取溴,其生产流程如下: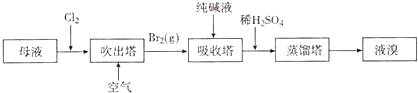
①若吸收塔中的溶液含BrO3﹣ , 则吸收塔中反应的离子方程式为 .
②母液中通入Cl2已获得含溴的溶液,为何还需经过吹出、吸收、酸化来重新获得含Br2的溶液 .
③向蒸馏塔中通人水蒸气加热,控制温度在90℃左右进行蒸馏的原因是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关晶体的叙述中正确的是( )
A.冰熔化时水分子中共价键发生断裂
B.原子晶体中只存在共价键,一定不含有离子键
C.金属晶体的熔沸点均很高
D.分子晶体中一定含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).
请回答下列问题:
(1)若A为第三周期的金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,F的浓溶液与A、D反应都有红棕气体生成,则A的原子结构示意图为;反应④的化学方程式为: .
(2)若A为用量最大的金属,D、F是气态单质,反应②的离子方程式是: , A与水蒸气反应的化学方程式为: .
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,B常用作光导纤维,A、F所含元素同周期,则E的电子式为 , 反应①的化学方程式为 . 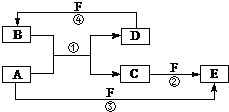
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2C12)的结构式为Cl﹣S﹣S﹣Cl,易与水反应:2S2Cl2+2H2O=4HCl+SO2↑+3S↓.对该反应下列说法正确的是( )
A.S2C12做氧化剂,H2O做还原剂
B.氧化产物与还原产物的物质的量之比为l:3
C.每生成l mol SO2转移4 mol电子
D.每生成48g硫会断裂6mol共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com