
| A. | 0.1mol•L-1的醋酸的pH=a,0.01mol•L-1的醋酸的pH=b,则a+1=b | |
| B. | 用200mL 4mol•L-1的NaOH溶液将0.6mol CO2完全吸收,反应的离子方程式为:3CO2+4OHˉ═CO32ˉ+2HCO3ˉ+H2O | |
| C. | 难溶电解质AB2的饱和溶液中,c(A2+)=xmol•L-1,c(B-)=y mol•L-1,则Ksp值为4xy2 | |
| D. | 常温下0.1mol•L-1的醋酸溶液与等浓度等体积NaOH溶液反应后的溶液中:c(CH3COOH)+c(CH3COOˉ)=0.1 mol•L-1 |
分析 A.将pH=a的弱酸稀释10倍,弱酸的电离被促进,溶液的pH增大不到1;
B.根据钠元素和碳元素的守恒来分析;
C.难溶电解质AB2的电离方程式为:AB2(S)?A 2+(aq)+2 B-(aq),Ksp=c(A 2+)•c2( B-),据此分析解答.
D.0.1 mol•L-1的醋酸溶液与等浓度等体积NaOH溶液反应后的溶液中醋酸钠的浓度为0.05mol/L,根据物料守恒来分析.
解答 解:A.将pH=a的弱酸稀释10倍,弱酸的电离被促进,溶液的pH增大不到1,故0.1 mol•L-1的醋酸的pH=a,则稀释10倍后的0.01 mol•L-1的醋酸的pH=b<a+1,故A错误;
B.设产物中Na2CO3的物质的量为Xmol,NaHCO3的物质的量为Ymol,根据钠元素守恒可知:2X+Y=0.8mol①,根据碳元素的守恒可知:X+Y=0.6mol②,解得:X=0.2mol、Y=0.4mol,故生成的Na2CO3和NaHCO3的物质的量之比为1:2,故离子方程式为:3CO2+4OHˉ=CO32ˉ+2HCO3ˉ+H2O,故B正确;
C.难溶电解质AB2的电离方程式为:AB2(S)?A 2+(aq)+2 B-(aq),AB2饱和溶液中,c(A2+)=xmol•L-1,c(B-)=ymol•L-1,则Ksp=c(A 2+).c2( B-)=xy2,故C错误;
D.0.1 mol•L-1的醋酸溶液与等浓度等体积NaOH溶液反应后的溶液中醋酸钠的浓度为0.05mol/L,根据物料守恒可有:c(CH3COOH)+c(CH3COOˉ)=0.05 mol•L-1,故D错误;
故选B.
点评 本题考查较为综合,涉及弱电解质在水溶液中的电离平衡、离子方程式的书写、难溶电解质的溶解平衡及沉淀转化的本质、离子浓度大小的比较等知识,题目难度中等,注意掌握弱酸的稀释时pH的变化、产物的分析和难溶电解质的Ksp的表达式的书写方法,试题培养了学生的分析能力及灵活应用能力.


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:解答题
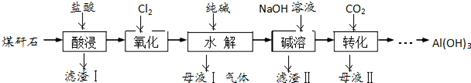
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
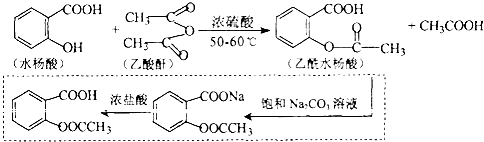


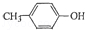 也能与乙酸酐发生类似反应,请写出化学反应方程式,可不写条件:
也能与乙酸酐发生类似反应,请写出化学反应方程式,可不写条件: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制0.1mol/L CuSO4溶液100 mL,需称量CuSO4•5H2O 1.6g | |
| B. | 40g NaOH固体溶于1 L水,所得溶液的浓度为1 mol/L | |
| C. | 200mL 0.2mol/L MgCl2溶液中Cl-的个数为0.08NA | |
| D. | 从100mL 1mol/L H2SO4溶液取出10mL溶液,此溶液的浓度为0.1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 10HCl□
10HCl□查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO3和NaHCO3的中性混合溶液中(S和C均用R表示):c(Na+)=c(HRO3-)+c(RO32-) | |
| B. | 常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)>c(Cl-)>c(CH3COOH) | |
| C. | 常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中水的电离程度:①>③>② | |
| D. | 等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数:N前>N后 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)+c(HA)=c(OH-) | B. | c(OH-)<c(H+)<c(B+)<c(A-) | ||
| C. | c(H+)+c(B+)<c(A-)+c(OH-) | D. | c(A-)=c(B+)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化亚铁与稀盐酸反应:FeO+2H+═Fe3++H2O | |
| B. | 将Na投入到CuSO4溶液:2Na+Cu2+═2Na++Cu | |
| C. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| D. | SiO2与NaOH溶液反应:SiO2+2OH-═SiO32-+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com