
A镍(Ni)可形成多种配合物,且各种配合物有广泛的用途。
(1)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于 ____________晶体;基态Ni原子的电子排布式为 _______________;
写出两种与配体CO互为等电子体微粒的化学式_____________、________________ 。
(2)某镍配合物结构如图所示,分子内含有的作用力有____________(填序号)。
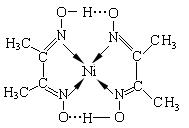
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应,
如①CH2=CH2、②HC ≡ CH、③ ![]() ④HCHO等,其中碳原子采取sp2杂化的分子有_________(填序号);HCHO分子的空间构型为:__________。
④HCHO等,其中碳原子采取sp2杂化的分子有_________(填序号);HCHO分子的空间构型为:__________。
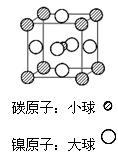
(4)据报道,某种含有镁、镍和碳三种元素的晶体具有超导性,其结构如图所示。则该晶体的化学式为__________ 。晶体中每个镁原子周围距离最近的镍原子有 _________个。
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:阅读理解
 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.| A-B | A=B | A≡B | ||
| CO | 键能(kJ?mol-1) | 357.7 | 798.9 | 1071.9 |
| 键能差值(kJ?mol-1) | 441.2 273 | |||
| N2 | 键能(kJ?mol-1) | 154.8 | 418.3 | 941.7 |
| 键能差值(kJ?mol-1) | 263.6 523.3 | |||
查看答案和解析>>
科目:高中化学 来源: 题型:
碳元素是形成单质及其化合物种类最多的元素。回答下列有关问题。
(1)碳元素可形成多种不同形式的单质,下列是几种单质的结构图
a b
c
观察上述结构,判断a中碳原子的杂化方式为 ,b对应的物质是 ,
c是C60的分子结构模型,在每个C60分子中形成的σ键数目为 。
(2)在C60单质中,微粒之间的作用力为 ,C60能与金属钾化合生成具有超导性的K3C60,在K3C60中阴阳离子个数比为1∶3,则K3C60属于 晶体。
(3)CO是碳元素的常见氧化物,分子中C原子上有一对孤对电子,与N2互为等电子体,则CO的结构式为 ;写出另一与CO互为等电子体的化学式 。
(4)CO可以和很多过渡金属形成配合物。金属镍粉在CO气流中轻微地加热,可生成液态的Ni(CO)4,用配位键表示Ni(CO)4 的结构为 ;写出基态Ni原子的电子排布式 。
(5)科学发现,C和Ni、Mg元素的原子形成的晶体也具有超导性,其晶胞的结构特点如右图,则该化合物的化学式为 ; C、Ni、Mg三种元素中,电负性最大的是 。
(6)碳的氢化物甲烷在自然界中广泛存在,其中可燃冰是有待人类开发的新能源。可燃冰是一种笼状结构,CH4分子存在于H2O分子形成的笼子中(如右图所示)。两种分子中,共价键的键能 ;CH4分子与H2O分子的分子量相差不大,但两种物质的熔沸点相差很大,其主要原因是 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江苏省海门市高二下学期期末教学质量调研化学试题 题型:填空题
碳元素是形成单质及其化合物种类最多的元素。回答下列有关问题。
(1)碳元素可形成多种不同形式的单质,下列是几种单质的结构图
a  b
b  c
c 
观察上述结构,判断a中碳原子的杂化方式为 ,b对应的物质是 ,
c是C60的分子结构模型,在每个C60分子中形成的σ键数目为 。
(2)在C60单质中,微粒之间的作用力为 ,C60能与金属钾化合生成具有超导性的K3C60,在K3C60中阴阳离子个数比为1∶3,则K3C60属于 晶体。
(3)CO是碳元素的常见氧化物,分子中C原子上有一对孤对电子,与N2互为等电子体,则CO的结构式为 ;写出另一与CO互为等电子体的化学式 。
(4)CO可以和很多过渡金属形成配合物。金属镍粉在CO气流中轻微地加热,可生成液态的Ni(CO)4,用配位键表示Ni(CO)4的结构为 ;写出基态Ni原子的电子排布式 。
(5)科学发现,C和Ni、Mg元素的原子形成的晶体也具有超导性,其晶胞的结构特 点如右图,则该化合物的化学式为 ; C、Ni、Mg三种元素中,电负性最大的是 。
点如右图,则该化合物的化学式为 ; C、Ni、Mg三种元素中,电负性最大的是 。
(6)碳的氢化物甲烷在自然界中广泛存在,其中可燃冰是有待人类开发的新能源。可燃冰是一种笼状结构,CH4分子存在于H2O分子形成的笼子中(如右图所示)。两种分子中,共价键的键能 ;CH4分子与H2O分子的分子量相差不大,但两种物质的熔沸点相差很大,其主要原因是 。
查看答案和解析>>
科目:高中化学 来源:2012届江苏省海门市高二下学期期末教学质量调研化学试题 题型:填空题
碳元素是形成单质及其化合物种类最多的元素。回答下列有关问题。
(1)碳元素可形成多种不同形式的单质,下列是几种单质的结构图
a  b
b  c
c 
观察上述结构,判断a中碳原子的杂化方式为 ,b对应的物质是 ,
c是C60的分子结构模型,在每个C60分子中形成的σ键数目为 。
(2)在C60单质中,微粒之间的作用力为 ,C60能与金属钾化合生成具有超导性的K3C60,在K3C60中阴阳离子个数比为1∶3,则K3C60属于 晶体。
(3)CO是碳元素的常见氧化物,分子中C原子上有一对孤对电子,与N2互为等电子体,则CO的结构式为 ;写出另一与CO互为等电子体的化学式 。
(4)CO可以和很多过渡金属形成配合物。金属镍粉在CO气流中轻微地加热,可生成液态的Ni(CO)4,用配位键表示Ni(CO)4 的结构为 ;写出基态Ni原子的电子排布式 。
(5)科学发现,C和Ni、Mg元素的原子形成的晶体也具有超导性,其晶胞的结构特点如右图,则该化合物的化学式为 ; C、Ni、Mg三种元素中,电负性最大的是 。

(6)碳的氢化物甲烷在自然界中广泛存在,其中可燃冰是有待人类开发的新能源。可燃冰是一种笼状结构,CH4分子存在于H2O分子形成的笼子中(如右图所示)。两种分子中,共价键的键能 ;CH4分子与H2O分子的分子量相差不大,但两种物质的熔沸点相差很大,其主要原因是 。

查看答案和解析>>
科目:高中化学 来源: 题型:
(09盐城第三次调研)在Ni、NiO、Ni3C、γ-Al2O3组成的催化剂表面,可实现H2O、CO2及CH4合成乙醇。
 (1)下列说法正确的是 (选填序号)。
(1)下列说法正确的是 (选填序号)。
A.第一电离能:碳原子大于氧原子
B.CO2分子中含有2个σ键和2个π键
C.CH4分子中碳原子采用sp3杂化
D.二甲醚的沸点比乙醇高
(2)镍原子基态时的核外电子排布式 。
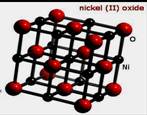
(3)NiO晶胞如右上图所示,每个晶胞中与每个Ni2+距离相等且最近的Ni2+有 个,某种有缺陷的氧化镍晶体
由Ni2+、Ni3+、O2-及空隙组成,可表示为Ni0.98O,则n(Ni2+)/n(Ni3+)= 。
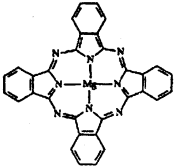
(4)对苯二甲酸( ![]() )、4,4’-联吡啶[
)、4,4’-联吡啶[![]() (可简化为
(可简化为 ![]() )]等与Ni2+能形成多核配合物。配合物[Ni2(TPHA)(bpy)4](ClO4)2络离子的结构如下图:
)]等与Ni2+能形成多核配合物。配合物[Ni2(TPHA)(bpy)4](ClO4)2络离子的结构如下图:

该络合物中配位原子是: ;依据价层互斥理论,ClO4-空间结构为 型。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com