
分析 (1)A.CH4均为一次能源,CO为二次能源;
B.CO和CH4都是共价化合物;
C.CO和CH4在燃料电池中都失电子发生氧化反应;
D.CH4不完全燃烧时,放出的热量较少;
E.相同状况下,等体积的两气体完全燃烧都生成二氧化碳,所以CO转移4-2=2mol电子,而甲烷转移的电子数为4-(-4)=8mol;
(2)根据1molCO完全燃烧放出热能283kJ,1molCH4完全燃烧放出热能890kJ,所以等体积的CH4和CO完全燃烧,前者放出的热能是后者的$\frac{890}{283}$倍;
(3)该燃料电池中,正极上氧气得电子生成氧离子;负极上甲烷失电子和氧离子反应生成二氧化碳和水;原电池放电时,电解质中阴离子向负极移动,失电子的极是负极,据此回答判断;
(4)依据化学平衡三段式列式计算得到,依据H2表示的平均反应速率=$\frac{△c}{△t}$,CH4的转化率=$\frac{消耗量}{起始量}$进行计算.
解答 解:(1)A.CH4均为一次能源,CO为二次能源,故错误;
B.CO和CH4都是共价化合物,所以都含共价键,故正确;
C.CO和CH4在燃料电池中都失电子发生氧化反应,均作负极,故正确;
D.CH4不完全燃烧时,放出的热量较少,所以热能利用率低,故正确;
E.相同状况下,等体积的两气体完全燃烧都生成二氧化碳,所以CO转移4-2=2mol电子,而甲烷转移的电子数为4-(-4)=8mol,则转移的电子数不同,故错误;
故选:BCD;
(2)根据1molCO完全燃烧放出热能283kJ,1molCH4完全燃烧放出热能890kJ,所以等体积的CH4和CO完全燃烧,前者放出的热能是后者的$\frac{890}{283}$=3.14倍,故答案为;3.14;
(3)该燃料电池中,正极上氧气得电子生成氧离子,电极反应式为O2+4e-=2O2-,负极上甲烷失电子和氧离子反应生成二氧化碳和水,电极反应式为CH4-8e-+4O2-═CO2+2H2O,放电时,电解质中阴离子向负极移动、阳离子向正极移动,所以氧离子向负极移动,故答案为;O2+4e-═2O2-,CH4-8e-+4O2-═CO2+2H2O,正极流向负极;
(4)在一定温度下,在2L的密闭容器中加入2mol CH4和1molO2,5分钟后反应达平衡,设反应转换了氧气物质的量为xmol,依据平衡三段式得到:
2CH4+O2?2CO+4H2
起始量(mol) 2 1 0 0
变化量(mol) 2x x 2x 4x
平衡量(mol) 2-2x 1-x 2x 4x
测得此时容器内气体的压强为起始时的1.9倍,所以有$\frac{2-2x+1-x+2x+4x}{2+1}$=1.9,解得x=0.9mol,
则H2表示的平均反应速率=$\frac{△c}{△t}$=$\frac{\frac{4×0.9}{2}}{5}$=0.36mol/(L.min),
CH4的转化率=$\frac{消耗量}{起始量}$=$\frac{2×0.9}{2}$×100%=90%;
故答案为:0.36mol/(L.min);90%.
点评 本题考查燃料的应用以及化学平衡三段式计算应用,注意燃料电池的原理以及转化率的概念理解,掌握基础是解题关键,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 E的氢化物的分子式H2O.
E的氢化物的分子式H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
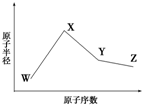 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的、半导体材料;Z原子得电子能力是同周期主族元素中最大的.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的、半导体材料;Z原子得电子能力是同周期主族元素中最大的.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2与水的反应:3NO2+H2O═2NO3-+NO+2H+ | |
| B. | 向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 将少量SO2通入冷氨水中:SO2+NH3•H2O═HSO3-+NH4+ | |
| D. | 用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-═Ag++NO↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(l);△H1 2H2(g)+O2(g)═2H2O(g);△H2 | |
| B. | 2S(g)+O2(g)═2SO2(g);△H1 2S(s)+O2(g)═2SO2(g);△H2 | |
| C. | C(s)+$\frac{1}{2}$O2(g)═CO(g);△H1C(s)+O2(g)═CO2(g);△H2 | |
| D. | H2(g)+Cl2(g)═2HCl(g);△H1 $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g);△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | X | Y | Z |
| 初始物质的量(mol) | 0.2 | 0.4 | 0 |
| 平衡物质的量(mol) | 0.1 | 0.1 | 0.2 |
| A. | 反应可表示为X+3Y?2Z,其平衡常数为400 | |
| B. | 向该容器中再加入0.1mol X、0.1mol Y、0.2mol Z,平衡不移动 | |
| C. | 若向容器中再加入0.1mol X,因平衡向右移动,则X、Y、Z的转化率均增大 | |
| D. | 若升高温度时,Z的浓度增大,则容器内的压强增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com