
食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
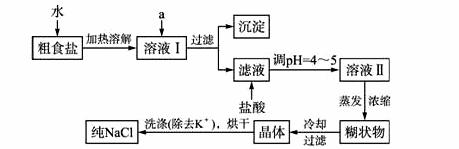
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液I中的Ca2+、Mg2+、Fe3+、NO3-离子,选出a所代表的试剂,按滴加顺序依次为_________(只填化学式)。
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为_________。
(2)用提纯的NaCl配制500 mL 4.00 mol·L-1NaCl溶液,所用仪器除药匙、玻璃棒外还有________(填仪器名称)。
(3) 电解饱和食盐水的装置如图所示,若收集的H2为2 L,则同样条件下收集的Cl2______(填“>”、“=”或“<”)2 L,原因是__________。装置改进后,可用于制备NaOH溶液,若测定溶液中NaOH的浓度,常用的方法是_____________。

(4)实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
据此,从下列所给仪器装置中选择制备并收集H2的装置_______(填代号)和制备并收集干燥、纯净Cl2的装置_________(填代号)。
可选用制备气体的装置:


【答案】
(1)①BaCl2、NaOH、Na2CO3(NaOH溶液的加入顺序及是否答NaOH不影响得分)
②75%乙醇
(2)天平、烧杯、500 mL容量瓶、胶头滴管
(3)< 电解生成的氯气与电解生成的NaOH发生了反应 酸碱中和滴定
(4)e d
【解析】(1)①选择试剂时一定要注意先除去SO42-,则过量的Ba2+可在下一步除Ca2+时用CO32-一并除去,但钡盐应使用BaCl2,防止Ba(NO3)2引入NO3-。除Mg2+、Fe2+所用的NaOH在顺序上不受影响,所以滴加顺序为BaCl2、NaOH、Na2CO3(NaOH的位置可以变动)。
②少量的KCl一般可用少量蒸馏水洗去,但提供的试剂中只有75%乙醇最接近于水,不留杂质。
(3)Cl2溶解度大,并且有一部分与电解产生的NaOH发生反应,所以收集到的Cl2较少。
(4)选择装置要从制备、除杂、收集三个方面综合考虑。


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极其重要的作用。下列实验中所选用的仪器合理的是
①用50 mL量筒量取5.2 mL稀硫酸 ②用分液漏斗分离苯和四氯化碳的混合物 ③用托盘天平称量11.7g氯化钠晶体 ④用碱式滴定管取23.10 mL溴水 ⑤用瓷坩埚灼烧各种钠化合物 ⑥用250 mL容量瓶配制250 mL 0.2 mol/L的NaOH溶液
A.①②④ B.③⑥ C.②③④⑥ D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸铵和氧化铁红颜料,原料的综合利用率较高。其主要流程如下:

(1)反应Ⅰ前需在FeSO4溶液中加入_______________(填字母),以除去溶液中的Fe3+。
A.锌粉 B.铁屑
C.KI溶液D.H2
(2)反应Ⅰ需控制反应温度低于35 ℃,其目的是______________________________。
(3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是_______________。
(4)反应Ⅳ常被用于电解生产(NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验方法合理的是( )
A.可用水鉴别己烷、四氯化碳、乙醇三种无色液体
B.油脂皂化后可用渗析的方法使高级脂肪酸钠和甘油充分分离
C.可用澄清石灰水鉴别Na2CO3溶液和NaHCO3溶液
D.为准确测定盐酸与NaOH溶液反应的中和热,所用酸和碱的物质的量应相等
查看答案和解析>>
科目:高中化学 来源: 题型:
某种催化剂为铁的氧化物。化学兴趣小组在实验室对该催化剂中铁元素的价态进行探究:将适量稀硝酸加入少许样品中,加热溶解;取少许溶液,滴加KSCN溶液后出现红色。一位同学由此得出该催化剂中铁元素价态为+3的结论。
(1)请指出该结论是否合理并说明理由_______________________________________。
(2)请完成对铁元素价态的探究:
限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹;3 mol·L-1 H2SO4、3% H2O2、6 mol·L-1 HNO3、0.01 mol·L-1 KMnO4、NaOH稀溶液、0.1 mol·L-1 KI、20% KSCN、蒸馏水。
①提出合理假设
假设1:______________________________________________________________;
假设2:______________________________________________________________;
假设3:______________________________________________________________。
②设计实验方案证明你的假设(不要在答题卡上作答)
③实验过程
根据②的实验方案,进行实验。请在答题卡上按下表格式写出实验操作步骤、预期现象与结论。
| 实验操作 | 预期现象与结论 |
| 步骤1: | |
| 步骤2: | |
| 步骤3: | |
| …… |
查看答案和解析>>
科目:高中化学 来源: 题型:
以下实验或操作不能达到目的的是
A.用溴水鉴别苯、乙醇、四氯化碳
B.准确称取0.4000g的NaOH固体配成1000mL浓度为0.01000 mol·L-1的溶液
C.为除去苯中的少量苯酚,向混合物中加入适量的溴水后过滤
D.用激光笔检验淀粉溶液的丁达尔现象
查看答案和解析>>
科目:高中化学 来源: 题型:
下列符合化学实验“绿色化”的有:
①在萃取操作的演示实验中,将CCl4萃取溴水改为CCl4萃取碘水
②在铜和浓硝酸反应的实验中,将铜片改为可调节高度的铜丝
③将实验室的废酸液和废碱液中和后再排放
A ①② B ①③ C ②③ D ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
(A)某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了如图装置。倾斜A使稀硫酸(足量)与固体M充分反应,待反应停止后,B装置增重,C装置中溶液无变化,反应后进入量气管气体的体积为VmL(已折算成标准状况)
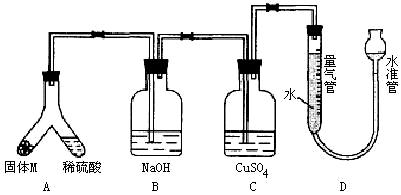
由上述实验事实可知:
(1)①固体M中一定有的物质是______________(填化学式)
理由是_____________________________________________________________
②其中一种物质的质量可以确定为___________g(用代数式表示)。
(2)B装置的名称是________。
写出B装置中反应的离子方程式_______________________________________。
(3)C装置的作用是_________________________,如果实验中没有B装置,则C装置中产生的现象是____________________________________________________________。
(4)稀硫酸和固体M反应后溶液中还残留淡黄色固体,该固体是_____________,要分离出该固体,在实验操作中,除烧杯外还需要用到的玻璃仪器是_____________。
(5)通过进一步实验,测得固体M中各种成分的质量之和小于反应前铁粉和硫粉的质量之和,产生这种现象的原因可能是_____________
a.M中有未反应的铁和硫
b.测定气体体积时水准管的水面高于量气管的水面
c.A中留有反应生成的气体
d.气体进入D装置前未用浓硫酸干燥
(B)
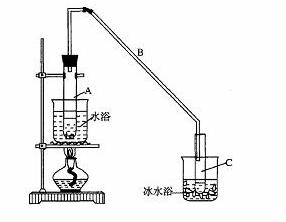
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
已知:
| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环已醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环已烯 | 0.81 | -103 | 83 | 难溶于水 |
(1)制备粗品
将12.5 mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热
至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是____________,导管B除了导气外还具有的作用是____________。
②试管C置于冰水浴中的目的是________________________________________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填上或下),分液后用_________(填入编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按下图装置蒸馏,冷却水从_________口进入。蒸馏时要加入生石灰,目的是__________________。
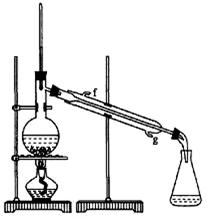
③收集产品时,控制的温度应在_________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是( )
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是_________。
a.用酸性高锰酸钾溶液
b.用金属钠
c.测定沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学为了验证Fe3+是否能氧化H2SO3生成了SO42–,他用50mL0.1mol/LFeCl3溶液吸收制取SO2气体的尾气,再进行以下实验:
(1)检验吸收液中的SO42–: ,则证明Fe3+能把H2SO3氧化为SO42–。
(2)请配平并完成上述反应中的化学方程式:
2FeCl3+SO2+ ==2FeCl2+H2SO4+2HCl,反应中的氧化产物是 (写化学式)。
(3)吸收液中除了含有H+、Cl–、SO42–以外,对其它成份(Fe3+、Fe2+、H2SO3)的可能组合进行探究:
①提出假设。
假设1:溶液中存在Fe3+、Fe2+;
假设2:溶液中存在 ;
假设3:溶液中存在Fe2+ 而不存在H2SO3 (二者恰好完全反应)。
②设计方案、进行实验,验证假设。请在表中写出实验步骤以及预期现象和结论(可以不填满)。限选实验试剂和仪器:试管、滴管、0.1moL L-1KMnO4、0.1moL
L-1KMnO4、0.1moL L-1KSCN溶液、品红稀溶液。
L-1KSCN溶液、品红稀溶液。
| 实验步骤 | 预期现象和结论 |
| 步骤1:用试管取样品溶液2~3mL,再用滴管取 | 若出现血红色,则假设1成立;若未出现血红色,则假设2或假设3成立。 |
| 步骤2:
| 结合步骤1的现象和结论,
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com