
����Ŀ����.����������C��H��O����Ԫ����ɣ�����������ӵ���Է�������Ϊ162���˴Ź���������ͼ��ʾ��6���壬�����֮��Ϊ1:2:2:1:1:3�����ú�������Ǽ�����е�ijЩ���ţ���ú����������ͼ��
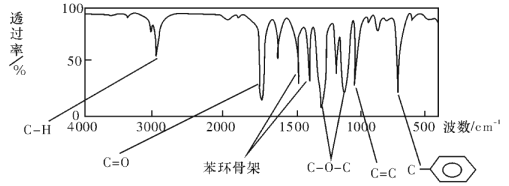
�����������Ľṹ��ʽ�� �������������칹��
��.����2.8g�л���A����ȫȼ������0.15molCO2��1.8gH2O��A������ͼ����ͼ��ʾ����֪��![]() ��XΪ±ԭ�ӣ�MΪ������������ȡ������)�����л���A�ϳ�G���㶹�أ��IJ������£�
��XΪ±ԭ�ӣ�MΪ������������ȡ������)�����л���A�ϳ�G���㶹�أ��IJ������£�
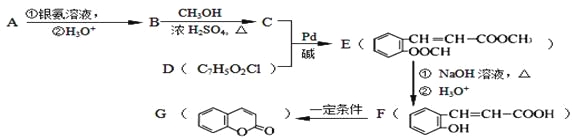
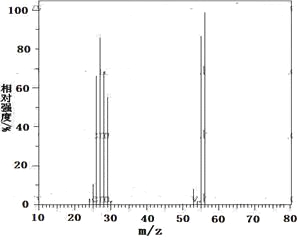
�ش��������⣺
��1��A�ķ���ʽΪ ��
��2��д��C�к�������������: ��F��G �ķ�Ӧ������ ��
��3��д��A��������Һ��Ӧ�Ļ�ѧ����ʽ ��
��4��F�ж���ͬ���칹�壬д��ͬʱ������������������ͬ���칹��Ľṹ��ʽ�� ��
��.�����г������⣬��������״�ṹ��
��.���������������ڶ�λ��ȡ������
��.�ܷ���ˮ�ⷴӦ��������Na��Ӧ��
��.��������Cu(OH)2�����ʵ�����1:2����������Ӧ
��5����֪��![]() (R��R��Ϊ����)����д���Ա��ͱ�ϩ��
(R��R��Ϊ����)����д���Ա��ͱ�ϩ��![]() ��CH��CH3��Ϊԭ�ϣ��ϳ�
��CH��CH3��Ϊԭ�ϣ��ϳ�![]() ��·������ͼ�� ��
��·������ͼ�� ��
�ϳ�·�ߵ���д��ʽ���£�
![]()
���𰸡���.
������1��C3H4O��2��������ȡ����Ӧ/������Ӧ
��3��CH2��CHCHO+2Ag(NH3)2OH![]() CH2��CHCOONH4+2Ag��+3NH3+H2O
CH2��CHCOONH4+2Ag��+3NH3+H2O
��4��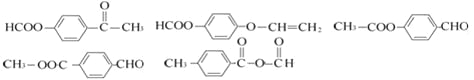
��5��

�������������������.������Է���������ȷ�������ʽΪC10H10O2,���ж��÷����к������ṹ����������6����ԭ�ӣ���������1:2:2:1:1:3�����Ը�����ֻ����һ��ȡ�����������л���IJ����Ͷȼ��㷽�����÷����л�����̼̼˫�����������������Ľṹ��ʽ��![]() ;
;
��.2.8g�л���A����ȫȼ������0.15molCO2��1.8gH2O��ˮ�����ʵ�����0.1mol�����л�����Ԫ�ص�������2.8g��0.15mol��12g/mol��0.2mol��1g/mol��0.8g������ԭ�ӵ����ʵ�����0.8g��16g/mol��0.05mol�����л��������C��H��O����ԭ�ӵĸ���֮����0.15:0.2:0.05��3:4:1������A������ͼ��֪A����Է�������������60�����Է���ʽӦ����C3H4O��A�ܷ���������Ӧ��˵������ȩ������A�Ľṹ��ʽΪCH2��CHCHO��B�Ľṹ��ʽΪCH2��CHCOOH��B��״�����������Ӧ����C����C�Ľṹ��ʽΪCH2��CHCOOCH3��������֪��Ϣ������E�Ľṹ��ʽ��֪��D�Ľṹ��ʽΪ![]() ��E������������Һ��ˮ�⣬�����ϼ�����F��F�к����ǻ����Ȼ������������ڵ�������Ӧ�γɻ���G��
��E������������Һ��ˮ�⣬�����ϼ�����F��F�к����ǻ����Ȼ������������ڵ�������Ӧ�γɻ���G��
��1���������Ϸ�����֪A�ķ���ʽΪC3H4O��
��2��C�к�������������Ϊ������F��G �ķ�Ӧ������ȡ����Ӧ��������Ӧ��
��3��A��������Һ��Ӧ�Ļ�ѧ����ʽΪCH2��CHCHO +2Ag(NH3)2OH![]() CH2��CHCOONH4+2Ag��+ 3NH3 +H2O��
CH2��CHCOONH4+2Ag��+ 3NH3 +H2O��
��4����.�����г������⣬��������״�ṹ����.���������������ڶ�λ��ȡ��������. �ܷ���ˮ�ⷴӦ��������Na��Ӧ��˵�������������������ǻ�����.��������Cu(OH)2�����ʵ�����1:2����������Ӧ��˵��������1��ȩ����������������л���ͬ���칹��ṹ��ʽΪ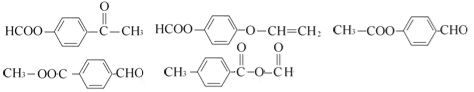 ��
��
��5���Ա��ͱ�ϩ��![]() ��CH��CH3��Ϊԭ�ϣ��ϳ�
��CH��CH3��Ϊԭ�ϣ��ϳ�![]() ��·������ͼ
��·������ͼ
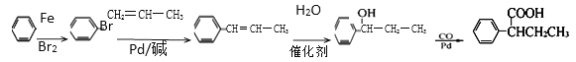


 ��˼ά������ҵ��ټ��ִ�ѧ������ϵ�д�
��˼ά������ҵ��ټ��ִ�ѧ������ϵ�д� �����������Ż�ѧϰϵ�д�
�����������Ż�ѧϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ʊ�ˮ����Ƶ��۵�ϵͣ�������ˮ��ӦʱҪ�ų�������������ˮ��Ӧ����Һ�ʼ��ԣ�ijѧ����һС�������Ͷ����з�̪��Һ��ˮ�У���ʵ����֤�������ĵ������еģ� ��
A.�٢�
B.�٢ڢ�
C.�٢ۢ�
D.�٢ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�̬ԭ�ӵĵ����Ų�ʽ��ȷ����( )
A. O 1s22s23s24s2
B. K 1s22s23p63s23p64s2
C. N 1s22s22p3
D. Cl 1s22s22p62s33p6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Ȼ����Ʒ����ɿ���ΪaNa2CO3bNaHCO3cH2O��a��b��cΪ����������Ϊȷ������ɣ�ijС���������ʵ�飺
��1������ʵ��
��ȡ������Ȼ����Ʒ�����Թ��У��þƾ��Ƽ��ȣ����Թܿ���Һ�����ɣ���Һ����ʹ��ˮ����ͭ������___________����������������������˵����Ʒ�к��ᾧˮ���Լ������� ��
�������һ��������ȷ����Ʒ�к���CO32�� ��
��2����������
��ͬѧ���������ͼ��ʾװ�ã��ⶨ��Ȼ��Ļ�ѧ�����
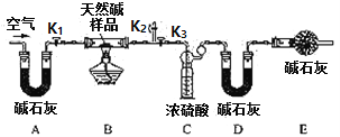
ʵ�鲽�裺
����װ��ʵ��װ�ú����Ƚ��еIJ����� ��A����ʯ�ҵ������ǣ�E����ʯ�ҵ������� ��
����7.3g��Ʒ������Ӳ�ʲ������У�����Cװ������Ϊ87.6g��Dװ��Ϊ74.7g��
������K1��K2���ر�K3��ͨ��������������
���رջ���Kl��K2����K3����ȼ�ƾ��������ٲ�������Ϊֹ��
������Kl���������������ӣ�Ȼ��Ƶ�Cװ������Ϊ88.5g��Dװ������Ϊ75.8g��ͨ�������Ŀ���� ��
�����a=1�������Ȼ��Ļ�ѧʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��KClO3 + 6HCl��Ũ���� KCl + 3Cl2 + 3H2O�����������뻹ԭ�������ʵ���֮��Ϊ�� ��
A. 5 : 1 B. 1 : 5 C. 6 : 1 D. 1 : 6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����У���ȫȼ��ʱ����CO2��H2O�����ʵ���֮��Ϊ1 ��1����
A. C2H6 B. C2H4 C. C2H2 D. C6H6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���ij��ɫ��Һ�����Ӽ���IJ�������������۶�Ӧ��ȷ���ǣ� ��
������� | ���� | ���� | |
A | ���������ữ���Ȼ��� | ������ɫ���� | һ���� SO42- |
B | ������ˮ�����Ȼ�̼ | �л������ɫ | һ���� I- |
C | ��������ϡ���� | ������ɫ���� | һ���� CO32- |
D | ���������� | ������ɫ���� | һ���� Cl- |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ྻú�������о����������൱�ձ飬������Աͨ�������ú������¯�н�����������ˮ�����ķ��������������˸���ֵ��ú̿��������Ҫ�ɷ���CO��H2��CO��H2����Ϊ��Դ�ͻ���ԭ�ϣ�Ӧ��ʮ�ֹ㷺������ú̿���ķ�Ӧ֮һ�ǣ�
C(s)+H2O(g)![]() CO(g)+H2(g)��H=+131.4kJ/mol
CO(g)+H2(g)��H=+131.4kJ/mol
��1�����ݻ�Ϊ3 L���ܱ������з���������Ӧ��5 min��������������ܶ�������0.12 g/L����H2O��ʾ0 ~ 5 min��ƽ����Ӧ����Ϊ______________________��
��2������������Ӧ�ڻ�ѧƽ��״̬ʱ��������ȷ���� ��
A��CO�ĺ������ֲ���
B��v����H2O��= v����H2��
C�������л�������ƽ����Է����������ֲ���
��3����������Ӧ��t0ʱ�̴ﵽƽ�⣨��ͼ������t1ʱ�̸ı�ijһ������������ͼ�м�������t1ʱ��֮������Ӧ������ʱ��ı仯��
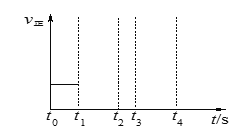
����С���������t2ʱ����ƽ�⣨��ʵ�߱�ʾ����
��t3ʱƽ�ⳣ��Kֵ���t4����ƽ�⣨�����߱�ʾ����
��4����һ����������CO��H2�����Ƶü״���CH3OH��CO��ȼ����Ϊ��725.8 kJ/mol ��283.0 kJ/mol��ˮ��Ħ��������Ϊ44.0 kJ/mol��д���״�����ȫȼ������һ����̼����̬ˮ���Ȼ�ѧ����ʽ�� ��
��5������ͼ��ʾ���Լ״�ȼ�ϵ����Ϊ��Դʵ�����е����̡��ҳ��з�����Ӧ�����ӷ���ʽΪ �����׳�������16 gʱ�������������ϲ����������������ֵΪ g��
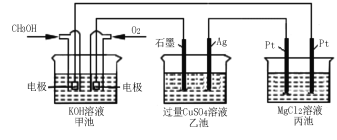
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����е����ֹ�̬�����ۻ�������ʱ���˷������������������ͬ�����͵���(����)
A. ����Ȼ��� B. ���ʯ���ؾ�ʯ
C. ��������ɱ� D. ������̼�ͼ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com