
【题目】下列各组中的两种固态物质熔化或升华时,克服的微粒间相互作用力属于同种类型的是( )
A. 碘和氯化钾 B. 金刚石和重晶石
C. 二氧化硅和干冰 D. 二氧化碳和甲烷
 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.肉桂酸甲酯由C、H、O三种元素组成,质谱分析其分子的相对分子质量为162,核磁共振氢谱谱图显示有6个峰,其面积之比为1:2:2:1:1:3,利用红外光谱仪检测其中的某些基团,测得红外光谱如下图:
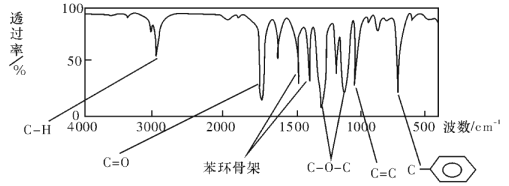
则肉桂酸甲酯的结构简式是 (不考虑立体异构)
Ⅱ.现有2.8g有机物A,完全燃烧生成0.15molCO2和1.8gH2O,A的质谱图如下图所示:已知:![]() (X为卤原子,M为烃基或含酯基的取代基等),由有机物A合成G(香豆素)的步骤如下:
(X为卤原子,M为烃基或含酯基的取代基等),由有机物A合成G(香豆素)的步骤如下:
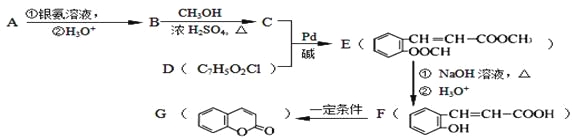
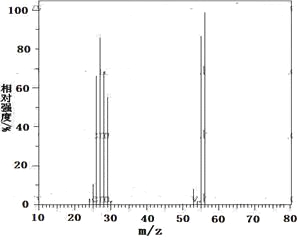
回答下列问题:
(1)A的分子式为 。
(2)写出C中含氧官能团名称: ;F→G 的反应类型是 。
(3)写出A和银氨溶液反应的化学方程式 。
(4)F有多种同分异构体,写出同时满足下列条件的两种同分异构体的结构简式: 。
Ⅰ.分子中除苯环外,无其它环状结构;
Ⅱ.苯环上有两个处于对位的取代基;
Ⅲ.能发生水解反应,不能与Na反应;
Ⅳ.能与新制Cu(OH)2按物质的量比1:2发生氧化反应
(5)又知:![]() (R,R′为烃基),试写出以苯和丙烯(
(R,R′为烃基),试写出以苯和丙烯(![]() =CH—CH3)为原料,合成
=CH—CH3)为原料,合成![]() 的路线流程图: 。
的路线流程图: 。
合成路线的书写格式如下:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,有下列气体分子数相同的可逆反应,其平衡常数K值分别如下:
①H2+F2=2HF K=1047 ②H2+Cl2=2HCl K=1017
③H2+Br2=2HBr K=109 ④H2+I2=2HI K=1
试判断平衡时各反应的正反应进行的程度由大到小的顺序是
A. ①②③④ B. ④②③① C. ①④③② D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化工生产原理错误的是:①可以用电解熔融的氯化铝的方法来制取金属铝 ②可以把钠加入氯化镁饱和溶液中制取镁 ③用热分解法冶炼铁 ④湿法炼铜是用锌和硫酸铜溶液反应置换出铜
A.②③ B.①③ C.①②③ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组用下图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。
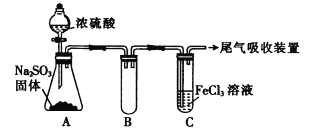
(1) 反应开始一段时间后,装置C中的现象为__________。
(2) 根据以上现象,该小组同学认为SO2与FeCl3溶液发生了氧化还原反应。
① 写出SO2与FeCl3溶液反应的离子方程式:____________。
② 向装置C中通入足量SO2发生反应后,检验生成的Fe2+的方法是__________。
③该小组同学向反应后的装置C的试管中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,则证明反应生成了SO42-。该做法不合理的理由是__________________。
(3)若将装置C中FeCl3溶液更换为Fe(NO3)3和BaCl2的混合液,可观察到装置C中出现白色沉淀,该小组对装置C中产生沉淀的原因提出下列假设(不考虑各因素的叠加):
假设1:装置A中白雾进入装置C中参与反应。
假设2: _______________________。
假设3:在酸性条件下NO3-能氧化SO2。
(4)请你设计实验验证上述假设3,写出实验步骤、预期现象和结论。
实验步骤(简述操作过程) | 预期现象和结论 |
① ② ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X的原子有3个电子层,最外层有4个电子.这种元素位于周期表的( )
A.第4周期ⅢA族
B.第4周期ⅦA族
C.第3周期Ⅳ族
D.第3周期ⅣA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:
2X(g)+Y(g)![]() Z(g) △H<0,反应经60s达到平衡并生成0.3 mol Z,则下列说法中正确的是
Z(g) △H<0,反应经60s达到平衡并生成0.3 mol Z,则下列说法中正确的是
A. 以Y浓度变化表示的反应速率为0.0005 mol/(L·s)
B. 其他条件不变,将容器体积扩大至20 L,则Z的平衡浓度变为原来的1/2
C. 其他条件不变,将容器体积缩小至5L,平衡正向移动,平衡常数增大
D. 其他条件不变,升高温度逆反应速率加快,正反应速率减慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
A. 向BaCl2溶液中加入适量Na2CO3溶液后,静置,向上层清液中继续滴加Na2CO3溶液,若无沉淀,说明Ba2+已经完全沉淀
B. 淀粉在稀硫酸的作用下水解后,加NaOH溶液使溶液呈碱性,加入新制Cu(OH)2,加热,若有红色沉淀生成,说明淀粉已经完全水解
C. 将Na2SO4·10H2O晶体置于坩埚中加热,冷却后称量,并重复上述操作,若相邻两次称量的结果相同,说明硫酸钠已全部失去结晶水
D. 用酸式滴定管向滴有酚酞的NaOH溶液中滴加标准HCl溶液,若滴入最后一滴HCl溶液后粉红色刚好褪去,说明已达滴定终点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com