


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
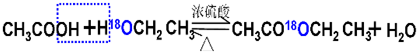
| 浓硫酸 |
| △ |
| 投料 | 产率 |
| 1:1 | 65% |
| 1:10 | 97% |
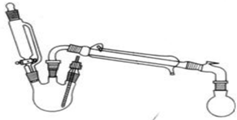
| 密度g/mL | 熔点/℃ | 沸点/℃ | 水溶性 | |
| 乙醇 | 0.79 | -114 | 78 | 溶 |
| 乙酸 | 1.049 | 16.2 | ~117 | 溶 |
| 乙酸乙酯 | 0.902 | -84 | ~76.5 | 不溶 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| a |
| b |
| 1 |
| 2 |
| a |
| b |
| a |
| b |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:3 | B、10:3 |
| C、2:3 | D、1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | R | W | X | Y | Z |
| 化合价 | -4 | +1 | -4 | -2 | -1 |
| A、离子还原性:Y2->Z- |
| B、离子半径W+>Z- |
| C、气态氢化物稳定性:RH4<XH4 |
| D、酸性:H2YO4<HZO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com