
【题目】铝鞣剂在皮革工业有广泛应用.某学习小组以铝灰为原料制备铝鞣剂[Al(OH)2Cl],设计如下化工流程(提示:铝灰的主要成分是Al、Al2O3、AlN,FeO等):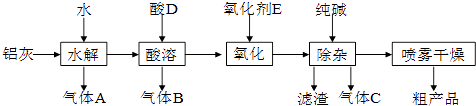
请回答下列问题:
(1)酸D的化学式为;气体C的电子式 .
(2)实验室检验气体A的操作是;“水解”温度保持在90℃左右,写出水解生成A的化学方程式: .
(3)“酸溶”温度控制在30℃~35℃,不宜太低,也不宜太高,其原因是;氧化剂E宜选择(填字母).A.漂白液 B.稀硝酸 C.酸性高锰酸钾溶液 D.溴水
(4)“除杂”过程中产生滤渣的离子方程式为 .
(5)粗产品略显浅黄色,可能含有的杂质主要是(填化学式).若用“蒸发”代替“喷雾干燥”,其后果是 .
【答案】
(1)HCl;![]()
(2)用镊子夹取一片湿润的红色石蕊试纸接触气体A,若试纸变蓝,则A为NH3;AlN+3H2O ![]() Al(OH)3+NH3↑
Al(OH)3+NH3↑
(3)温度太低,反应慢;温度太高,盐酸挥发快;A
(4)2Fe3++3CO ![]() +3H2O=2Fe(OH)3↓+3CO2↑
+3H2O=2Fe(OH)3↓+3CO2↑
(5)Fe(OH)3;Al(OH)2Cl水解生成Al(OH)3 , 几乎得不到Al(OH)2Cl
【解析】解:铝灰主要成分为Al、Al2O3、AlN、FeO等加入水发生反应,AlN和水反应生成氢氧化铝和氨气,即A为氨气,然后应加入盐酸酸溶后,生成氯化铝溶液和氯化亚铁溶液,生成气体B为氢气,可加入漂白剂氧化亚铁离子为铁离子,加入纯碱调节溶液PH使铁离子全部沉淀,生成气体C为二氧化碳气体,采用喷雾干燥制备铝鞣剂,(1)由以上分析可知D为盐酸,气体C为二氧化碳,电子式为 ![]() ,所以答案是:HCl;
,所以答案是:HCl; ![]() ;(2)A为氨气,为碱性气体,可用镊子夹取一片湿润的红色石蕊试纸接触气体A,若试纸变蓝,则A为NH3 , 铝灰中的AlN和水发生水解反应生成氢氧化铝沉淀和氨气,反应的化学方程式为AlN+3H2O
;(2)A为氨气,为碱性气体,可用镊子夹取一片湿润的红色石蕊试纸接触气体A,若试纸变蓝,则A为NH3 , 铝灰中的AlN和水发生水解反应生成氢氧化铝沉淀和氨气,反应的化学方程式为AlN+3H2O ![]() Al(OH)3+NH3↑,所以答案是:用镊子夹取一片湿润的红色石蕊试纸接触气体A,若试纸变蓝,则A为NH3;AlN+3H2O
Al(OH)3+NH3↑,所以答案是:用镊子夹取一片湿润的红色石蕊试纸接触气体A,若试纸变蓝,则A为NH3;AlN+3H2O ![]() Al(OH)3+NH3↑;(3)因温度太低,反应慢;温度太高,盐酸挥发快,则“酸溶”温度控制在30℃~35℃,不宜太低,也不宜太高,为避免引入其它杂质,可选用漂白液为氧化剂,所以答案是:温度太低,反应慢;温度太高,盐酸挥发快;A;(4)滤渣为氢氧化铁,可由铁离子与碳酸根离子水解生成,离子方程式为2Fe3++3CO32﹣+3H2O=2Fe(OH)3↓+3CO2↑,所以答案是:2Fe3++3CO32﹣+3H2O=2Fe(OH)3↓+3CO2↑;(5)产品含有Fe(OH)3 , 可导致略呈黄色,铝鞣剂主要成分为Al(OH)2Cl,在加热蒸发时会发生水解,为防止水解利用喷雾干燥,减少铝鞣剂水解,所以答案是:Fe(OH)3;Al(OH)2Cl水解生成Al(OH)3 , 几乎得不到Al(OH)2Cl.
Al(OH)3+NH3↑;(3)因温度太低,反应慢;温度太高,盐酸挥发快,则“酸溶”温度控制在30℃~35℃,不宜太低,也不宜太高,为避免引入其它杂质,可选用漂白液为氧化剂,所以答案是:温度太低,反应慢;温度太高,盐酸挥发快;A;(4)滤渣为氢氧化铁,可由铁离子与碳酸根离子水解生成,离子方程式为2Fe3++3CO32﹣+3H2O=2Fe(OH)3↓+3CO2↑,所以答案是:2Fe3++3CO32﹣+3H2O=2Fe(OH)3↓+3CO2↑;(5)产品含有Fe(OH)3 , 可导致略呈黄色,铝鞣剂主要成分为Al(OH)2Cl,在加热蒸发时会发生水解,为防止水解利用喷雾干燥,减少铝鞣剂水解,所以答案是:Fe(OH)3;Al(OH)2Cl水解生成Al(OH)3 , 几乎得不到Al(OH)2Cl.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在有机物分子中,不同氢原子的核磁共振谱中给出的信号也不同,根据信号可以确定有机物分子中氢原子的种类和数目.例如二乙醚的结构简式为:CH3﹣CH2﹣O﹣CH2﹣CH3 , 其核磁共振谱中给出的信号有两个,如图①所示: 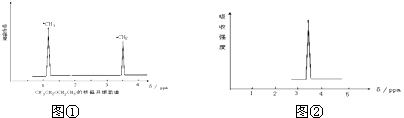
(1)下列物质中,其核磁共振氢谱中给出的信号只有一个的是 . (填序号)
A.CH3CH3
B.CH3COOH
C.CH3COOCH3
D.CH3OCH3
(2)化合物A和B的分子式都是C2H4Br2 , A的核磁共振氢谱图如右图②所示,则A的结构简式为 , 请预测B的核磁共振氢谱上有种信号.
(3)在常温下测得的某烃C8H10(不能与溴水反应)的核磁共振谱上,观察到两种类型的H原子给出的信号,其强度之比为2:3,试确定该烃的结构简式为;该烃在光照下生成的一氯代物在核磁共振谱中可产生种信号,强度比为 .
(4)在常温下测定相对分子质量为128的某链烃的核磁共振谱,观察到两种类型的H原子给出的信号,其强度之比为9:1,则该烃的结构简式为 , 其名称为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向容积为2 L的密闭容器中充人2 mol A气体和1 mol B气体,在一定条件下发生如下反应:2A(g)+B(g) ![]() 3C(g);经2 s后达到平衡,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是
3C(g);经2 s后达到平衡,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是
①用物质A表示该反应的平均反应速率为0.2 mol·L-1·s-1
②用物质B表示该反应的平均反应速率为0.2 mol·L-1·s-1
③平衡时物质A与B的转化率相等
④平衡时物质B的浓度为0.2 mol·L-1
A. ①②③ B. ①③ C. ②④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如图装置,研究非金属元素性质变化规律.
(1)已知硅酸(H2SiO3)是一种难溶于水的弱酸,呈白色.在化学反应中,一般地,强酸能制弱酸,如NaHCO3+HCl═NaCl+CO2↑+H2O,得出:HCl酸性强于H2CO3的酸性.现有硝酸溶液、碳酸钙、澄清石灰水、硅酸钠溶液,选择试剂用如图装置证明:
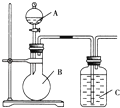
(1)酸性:HNO3>H2CO3>H2SiO3
A、B、C中装试剂分别为_______;C中实验现象为______________________;
写出C中发生反应的离子方程式____________________________.
(2)已知高锰酸钾在常温下与浓盐酸反应产生氯气,利用如图装置证明氯气氧化性强于碘单质的氧化性.则A中装浓盐酸,B中装入高锰酸钾粉末,C中装试剂_______,C中现象_______________,写出B中反应的离子方程式___________________________.
(3)如果C中装饱和氢硫酸溶液,A中装浓盐酸,B中装高锰酸钾溶液,反应开始后观察现象是C中产生淡黄色沉淀,写出化学方程式______;证明氯的非金属性比硫的非金属性______(填“强”或“弱”或“无法判断”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X,Y,Z三种气体的物质的量随时间变化的曲线如下图所示:下列描述正确的是( ) 
A.反应的化学方程式为:X(g)+Y(g)Z(g)
B.反应开始到10s,X的物质的量浓度减少了0.79mol/L
C.反应开始到10s时,Y的转化率为79.0%
D.反应开始到10s,用Z表示的反应速率为0.158mol/(Ls)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素。
A | B | ||||||
D | E | F | |||||
C | G | H |
(1)上述元素的单质中熔点最高的可能是________________(填名称)。
(2)D的氢化物比G的氢化物稳定,其原因是__________________________________________________________。
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为___________;该物质溶于水后的溶液呈________性(填“酸”、“碱”或“中”)。
(4)现有另一种元素X,其原子获得一个电子所释放出的能量是上表中所列元素中最大的,则X是周期表中第__________族元素。
(5)“神舟”六号载人飞船内需要有一种化合物来吸收航天员呼出的CO2,你认为该物质应该是由上表中的___________(填字母代号)元素组成的,用化学方程式表示吸收原理_________________________________________________________________。
飞船中需要制造一种适合航天员生存的人工态环境,还应该在氧气中充入一种稀释气体,该气体化学式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素是一种高效、速效抗疟药,是中医药献给世界的一份礼物.屠呦呦因在发现、研究青蒿素方面做出的杰出贡献而获得2015年诺贝尔医学奖.青蒿素分子结构如图,下列说法中正确的是( ) 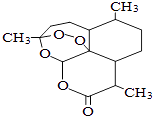
A.青蒿素能与热的NaOH溶液反应
B.青蒿素的分子式为C15H21O5
C.青蒿素分子结构中只含有极性键
D.青蒿素能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:在酸性条件下发生的反应为AsO43﹣+2I﹣+2H+═AsO33﹣+I2+H2O,在碱性条件下发 生的反应为AsO33﹣+I2+2OH﹣═AsO43﹣+H2O+2I﹣ . 设计如图装置(C1、C2均为石墨电极),分别进行下述操作: Ⅰ.向B烧杯中逐滴加入浓盐酸,发现电流表指针发生偏转
Ⅱ.若改向B烧杯中逐滴加入40% NaOH溶液 发现电流表指针偏转方向与Ⅰ相反. 试回答下列问题:
(1)两次操作过程中指针偏转方向为什么相反?试用化学平衡移动原理解释 .
(2)操作Ⅰ过程中C1棒为极,发生的电极反应为 .
(3)操作Ⅱ过程中C2棒为极,发生的电极反应为 . 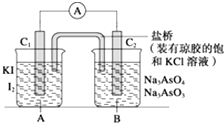
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“自元时始创其法,用浓酒和糟入甑,蒸令气上…其清如水,味极浓烈,盖酒露也。”文中所用之“法”是指( )
A. 萃取B. 渗析C. 蒸馏D. 过滤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com