
【题目】某同学设计如图装置,研究非金属元素性质变化规律.
(1)已知硅酸(H2SiO3)是一种难溶于水的弱酸,呈白色.在化学反应中,一般地,强酸能制弱酸,如NaHCO3+HCl═NaCl+CO2↑+H2O,得出:HCl酸性强于H2CO3的酸性.现有硝酸溶液、碳酸钙、澄清石灰水、硅酸钠溶液,选择试剂用如图装置证明:
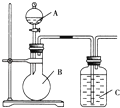
(1)酸性:HNO3>H2CO3>H2SiO3
A、B、C中装试剂分别为_______;C中实验现象为______________________;
写出C中发生反应的离子方程式____________________________.
(2)已知高锰酸钾在常温下与浓盐酸反应产生氯气,利用如图装置证明氯气氧化性强于碘单质的氧化性.则A中装浓盐酸,B中装入高锰酸钾粉末,C中装试剂_______,C中现象_______________,写出B中反应的离子方程式___________________________.
(3)如果C中装饱和氢硫酸溶液,A中装浓盐酸,B中装高锰酸钾溶液,反应开始后观察现象是C中产生淡黄色沉淀,写出化学方程式______;证明氯的非金属性比硫的非金属性______(填“强”或“弱”或“无法判断”)。
【答案】 HNO3、CaCO3、Na2SiO3 有白色沉淀生成 SiO32-+CO2+H2O=H2SiO3↓+CO32- 淀粉KI溶液 溶液变成蓝色 2MnO4-+10Cl-+16H+=2Mn2++5Cl2+8H2O Cl2+H2S=2HCl+S↓ 强
【解析】(1)要证明酸性:HNO3>H2CO3>H2SiO3,应该先加入硝酸和碳酸钙反应生成二氧化碳,二氧化碳通入硅酸钠溶液生成硅酸白色沉淀;因此装置C中反应是:SiO32-+CO2+H2O=H2SiO3↓+CO32-;(2)利用如图装置证明氯气氧化性强于碘单质的氧化性,C中发生的是氯气和碘离子的反应生成碘单质,碘单质遇淀粉变蓝,所以C中加入淀粉碘化钾;B中产生氯气,反应的方程式为2MnO4-+10Cl-+16H+=2Mn2++5Cl2+8H2O;(3)如果C中装饱和氢硫酸溶液,A中装浓盐酸,B中装高锰酸钾溶液,二者反应产生氯气,氯气氧化H2S生成单质硫,说明氯元素非金属性强于硫,因此反应开始后观察现象是C中产生淡黄色沉淀,反应的化学方程式为:Cl2+H2S=S↓+2HCl。


科目:高中化学 来源: 题型:
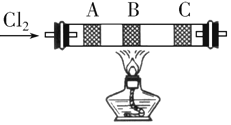
【题目】在硬质玻璃管中的A、B、C处依次放有浸有KBr溶液、KI溶液、淀粉![]() 已知淀粉遇
已知淀粉遇![]() 显蓝色
显蓝色![]() 溶液的3个棉球
溶液的3个棉球![]() 如图所示
如图所示![]() 由左端通入氯气,在B处加热,可观察到A处棉球呈______色,B处棉球呈现______色,C处棉球呈______色
由左端通入氯气,在B处加热,可观察到A处棉球呈______色,B处棉球呈现______色,C处棉球呈______色![]() 将玻璃管冷却后,在B、C之间的玻璃壁上有______色的______
将玻璃管冷却后,在B、C之间的玻璃壁上有______色的______![]() 填物质状态
填物质状态![]() ,这是因为______
,这是因为______ ![]() 、B两处发生的离子方程式分别是:______.
、B两处发生的离子方程式分别是:______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表是某指示剂在一定pH范围内所显示的颜色:向滴有少量该指示剂的稀硫酸中,加入氢氧化钠溶液,出现的颜色变化可能是( )
颜色 | 红 | 橙 | 绿 | 蓝 | 紫 |
PH范围 | 1~3 | 4~5 | 6~7 | 8~11 | 11~14 |
A.由红变紫
B.由蓝变绿
C.由绿变橙
D.由蓝变紫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理利用碳氢化合物以及二氧化碳捕集、存储和转化是当今化学研究的热点问题之一.
(1)将CH4设计成燃料电池,其利用率更高,装置示意如图(A、B为多孔性碳棒).持续通入甲烷,在标准状况下,消耗甲烷体积0<V<44.8L时,负极电极反应为;
(2)若以该燃料电池作为电源,用石墨作电极电解500mL 饱和食盐水,当两极共收集到标准状况下的气体1.12L(以不考虑气体的溶解)时,所得溶液的pH=(假设反应前后溶液体积不变).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答:
(1)H2O2的电子式 .
(2)镁燃烧不能用CO2灭火,用化学方程式表示其理由
(3)在AgCl沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程式 .
(4)完成以下氧化还原反应的离子方程式: MnO4﹣+C2O42﹣+=Mn2+CO2↑+ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z都是短周期元素,在元素周期表中的位置如图所示,下列有关说法正确的是( )

A. 原子半径:Z>Y>X
B. 氢化物的稳定性:X>Y、Z>Y
C. 最高价氧化物对应的水化物酸性:Y>X
D. 三种元素形成的简单离子的半径:X<Y<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝鞣剂在皮革工业有广泛应用.某学习小组以铝灰为原料制备铝鞣剂[Al(OH)2Cl],设计如下化工流程(提示:铝灰的主要成分是Al、Al2O3、AlN,FeO等):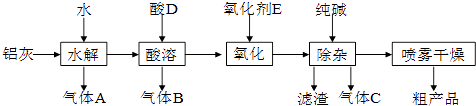
请回答下列问题:
(1)酸D的化学式为;气体C的电子式 .
(2)实验室检验气体A的操作是;“水解”温度保持在90℃左右,写出水解生成A的化学方程式: .
(3)“酸溶”温度控制在30℃~35℃,不宜太低,也不宜太高,其原因是;氧化剂E宜选择(填字母).A.漂白液 B.稀硝酸 C.酸性高锰酸钾溶液 D.溴水
(4)“除杂”过程中产生滤渣的离子方程式为 .
(5)粗产品略显浅黄色,可能含有的杂质主要是(填化学式).若用“蒸发”代替“喷雾干燥”,其后果是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 用加热分解的方法区分碳酸钠和碳酸氢钠两种固体
B. 由矿盐(主要成分是NaCl,还含有SO![]() 等其他可溶性杂质的离子)生产食盐,除去SO
等其他可溶性杂质的离子)生产食盐,除去SO![]() 最合适的试剂是BaCl2
最合适的试剂是BaCl2
C. 用酚酞试液可鉴别饱和食盐水和饱和纯碱溶液
D. 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA代表阿伏加德罗常数,下列说法中正确的是( )
A. 1 mol水含有的氢原子数目为NAB. 1 mol氩气分子所含的原子数目为2NA
C. 0.5 mol碳酸钠中含有的钠离子为0.5NAD. 0.5 mol硝酸中含有的氧原子为1.5NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com