
某化学兴趣小组用回收的镁铝合金制取氢气。现有10.8 g镁铝合金,下列说法正确的是( )
A.常温下与足量18 mol/L H2SO4溶液反应,最多可放出0.6 mol H2
B.常温下与足量2 mol/L HNO3溶液反应,最少可放出0.45 mol H2
C.常温下与足量2 mol/L H2SO4溶液反应,放出H2的物质的量在0~0.45 mol之间
D.常温下与足量2 mol/L NaOH溶液反应,放出H2的物质的量在0~0.6 mol之间
科目:高中化学 来源: 题型:
现有一部分氧化的Na2SO3样品ag,为了测定其中Na2SO3的质量分数,设计了如下方案,其中明显不合理的是
A. 将样品配制成溶液V1L,取其中25.00 mL用标准KMnO4溶液滴定,消耗标准KMnO4溶液V2 mL
B. 向样品中加足量H2O2,再加足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为b g
C. 将样品与足量稀盐酸充分反应后,再加入足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为c g
D. 将样品与足量稀盐酸充分反应,生成的气体依次通过盛有饱和NaHSO3的洗气瓶、盛有浓H2SO4的洗气瓶、盛有碱石灰的干燥管Ⅰ、盛有碱石灰的干燥管Ⅱ,测定干燥管Ⅰ增重d g
查看答案和解析>>
科目:高中化学 来源: 题型:
已知气体的摩尔质量越小,扩散速度越快。如图所示为气体扩散速度的实验,两种气体扩散相遇时形成白色烟环。下列关于甲、乙的判断正确的是( )
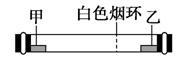
A、甲是浓氨水,乙是浓硫酸
B、甲是浓盐酸,乙是浓氨水
C、甲是浓氨水,乙是浓盐酸
D、甲是浓硝酸,乙是浓氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
有关氨气的实验较多,下面对这些实验原理的分析中,正确的是( )
A、氨气极易溶于水,可以用来做喷泉实验
B、氨气的还原性可以解释氨气与氯化氢的反应实验
C、NH3·H2O不稳定,实验室可用NH4Cl和石灰水制取氨气
D、NH3液化时放出大量的热,因而,不能用氨作制冷剂
查看答案和解析>>
科目:高中化学 来源: 题型:
相同质量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质,消耗碱量最多的是( )
A.Al B.Al(OH)3
C.AlCl3 D.Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关铝及其化合物的叙述正确的是( )
A.铝粉与三氧化钨共热可制取金属钨
B.足量铝分别与含1 mol HCl、1 mol NaOH的溶液反应,产生相同量的氢气
C.工业上用电解熔融Al2O3的方法冶炼铝
D.在浓硝酸中加入等体积的浓硫酸后,立即加入铝片,铝片表面发生钝化
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关问题与盐的水解无关的是( )
A.NH4Cl与ZnCl2溶液可作焊接金属时的除锈剂
B.用NaHCO3与Al2(SO4)3两种溶液可制成泡沫灭火剂
C.常温下测得NaHSO3溶液的pH小于7
D.实验室盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积为1L的密闭容器中,进行如下反应:A(g)+2B(g) C(g)+D(g),最初加入1.0molA和2.2molB,在不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:
C(g)+D(g),最初加入1.0molA和2.2molB,在不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:

(1)800℃时。0—5min内,以B表示的平均反应速率为
(2)能判断该反应达到化学平衡状态的依据是
A.容器中压强不变 B.混合气体中c(A)不变
C.2v正(B)=v逆(D) D.c(A)=c(C)
(3)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K= ,
该反应为 反应(填吸热或放热)
(4)700℃时,某时刻测得体系中各物质的量如下:n(A)=1.1mol,n(B)=2.6mol,n(C)=0.9mol, n(D)=0.9mol,则此时该反应 进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com