
| A、pH=8的某电解质的溶液 |
| B、c(OH)>1×10-7 mol?L-1 |
| C、常温下溶液中c(H+)<10-7 mol/L |
| D、溶液中含有OH- |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
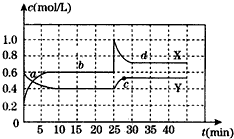
| A、第35min时,NO2的体积分数高于第15min时的体积分数 |
| B、T℃时,N2O4(g)?2NO2(g)的平衡常数为0.9 |
| C、a、b、C、d四点中,气体颜色最浅的是C点 |
| D、0~10min内反应体系对外界放热,25~30min内反应体系从外界吸热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、强电解质溶液导电能力一定很强,弱电解质溶液导电能力一定很弱 |
| B、同一弱电解质溶液,温度不同时,导电能力不同 |
| C、强电解质在溶液中完全电离,但溶液中存在电离平衡 |
| D、强电解质在固态或液态时,可能不导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向0.1mol/L的醋酸和饱和硼酸溶液中滴加等浓度的碳酸钠溶液,均有气体生成 |
| B、向氢氧化镁沉淀中滴加适量的盐酸和氯化铵溶液,沉淀均能溶解 |
| C、实验测定酸碱滴定曲线时,要保证整个过程测试和记录pH的间隔相同 |
| D、Ksp大的难溶电解质一定能转化成Ksp小的难溶电解质,Ksp小的难溶电解质一定不能转化成Ksp大的难溶电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②④ | B、①③ | C、②③ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、淀粉遇KI溶液会变蓝 |
| B、葡萄糖溶液能与新制氢氧化铜反应会生成红色的沉淀 |
| C、发烟硝酸在光照后变黄色 |
| D、氢气燃烧的火焰因玻璃管口含钠元素而呈黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电镀时,镀件接电源的正极,电镀材料接电源负极 |
| B、在船身上装锌块可避免船体遭受腐蚀 |
| C、充电时,把铅蓄电池的负极接在外电源的正极 |
| D、碱性氢氧燃料电池工作时,负极反应为:O2+2H2O+4e-=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N2在阴极上被氧化 | ||||
| B、可选用铁作为阳极材料 | ||||
| C、负极的电极反应式:N2+6e-+6H+═2NH3 | ||||
D、该过程的总反应式是N2+3H2
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com