
【题目】原子序数依次递增的短周期元素W、X、Y、Z组成的化合物a、b、c、d、e、f,其中b、c与人的呼吸活动息息相关,m为单质,它们的转化关系如图所示。下列叙述不正确的是
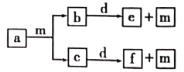
A.原子半径:W<Y<X<Z
B.由W、X、Y、Z构成的化合物中可能含有离子键、极性共价键和非极性共价键
C.X的氢化物沸点可能比Y的氢化物沸点高
D.Z2Y2中阴阳离子个数比为1:1
【答案】D
【解析】
原子序数依次递增的短周期元素W、X、Y、Z组成的化合物a、b、c、d、e、f,其中b、c与人的呼吸活动息息相关,m为单质,结合物质转化关系图,a应为由C、H或C、H、O组成的有机物,m为O2,b、c为CO2和H2O,d为Na2O2,e、f为Na2CO3、NaOH,由此分析可知W为H元素,X为C元素,Y为O元素,Z为Na元素,据此分析结合元素及其化合物性质解答。
A.W为H元素,X为C元素,Y为O元素,Z为Na元素,电子层数越多,原子半径越大,同周期元素核电荷数越大,原子半径越小,则原子半径:W<Y<X<Z,故A正确;
B.由H、C、O、Na构成的化合物可为醋酸钠(CH3COONa),CH3COONa是离子化合物,由钠离子和醋酸根离子构成,含有离子键;醋酸根离子(CH3COO-)内部,C-H、C=O、C-O键为极性共价键,C-C键为非极性共价键,故B正确;
C.X为C元素,Y为O元素,O的氢化物为水或双氧水,C、H元素可形成多种烃,一般随着碳原子数的增加,其熔沸点越高,则C的氢化物沸点可能比O的氢化物沸点高,故C正确;
D.Y为O元素,Z为Na元素,Z2Y2为Na2O2,属于离子化合物,由Na+和O22-构成,阴阳离子个数比为1:2,故D错误;
答案选D。


科目:高中化学 来源: 题型:
【题目】在一定条件下可实现下图所示物质之间的变化:
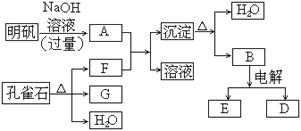
请填写以下空白:
(1)孔雀石的主要成分是CuCO3·Cu(OH)2(碱式碳酸铜),受热易分解。下图中的F是_____。
(2)写出明矾溶液与过量NaOH溶液反应的离子方程式:________。
(3)图中所得G和D都为固体,混和后在高温下可发生反应,写出该反应的化学方程式:____________。
(4)每生成1摩D,同时生成______摩E。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
①质子数相同的微粒一定属于同一种元素
②同位素的性质几乎相同
③质子数相同,电子数也相同的两种微粒,不可能是一种分子和一种离子
④某种元素的相对原子质量取整数,就是其质量数
⑤一种元素只能有一种质量数
⑥电子数相同的微粒不一定是同一种元素。
A.②③⑤⑥B.①②④⑤C.①②⑤⑥D.③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一无色透明溶液,取出少量滴入BaCl2溶液,只有白色沉淀生成;另取一定体积的无色溶液加入过量Na2O,有白色沉淀生成,其沉淀量与加入Na2O的量的关系如图所示。原无色透明溶液中一定存在的离子是
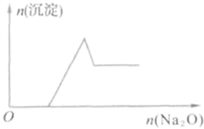
①H+ ②NH4+ ③Al3+ ④Mg2+ ⑤Fe2+ ⑥NO3- ⑦SO42-
A.③④B.③④⑦C.①③④⑦D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有![]() 的四种溶液:①
的四种溶液:①![]() ②
②![]() ③
③![]() ④
④![]()
(1)任选上述一种酸性溶液,用化学用语解释其呈酸性的原因:__________.
(2)溶液②的![]() _____________。
_____________。
(3)溶液②、③等体积混合后,溶液中![]() ________
________![]() (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(4)溶液④加热后碱性增强,结合化学用语解释原因:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对某溶液中部分离子的定性检测流程如图。下列相关分析正确的是( )
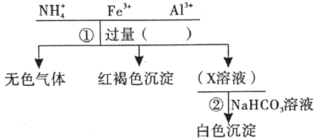
A.步骤①所加试剂可以是浓KOH溶液
B.可以用湿润的蓝色石蕊试纸检验生成的无色气体
C.步骤②的反应为Al3++3HCO3-=Al(OH)3↓+3CO2↑
D.检验Fe3+的离子反应方程式为Fe3++3SCN-=Fe(SCN)3↓(血红色)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)常用作催化剂和合成洗涤剂,某学习小组在实验室中用下图所示装置制备ClNO。查阅资料:亚硝酰氯(ClNO)的熔点为-64.5℃、沸点为-5.5℃,气态呈黄色,液态时呈红褐色,遇水易反应生成一种氢化物和两种氮的常见氧化物,其中一种呈红棕色。
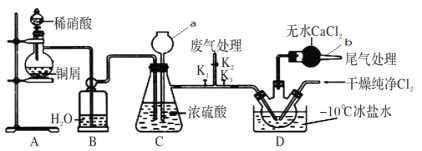
回答下列问题:
(1)仪器a的名称为________,b的作用是________。
(2)ClNO分子中各原子均满足8电子稳定结构,则ClNO的电子式为__________;ClNO与水反应的化学方程式为__________。
(3)实验开始时,先打开K1、K2,关闭K3,再打开分液漏斗活塞滴入适量稀硝酸,当观察到C中_________________时关闭K1、K2;向装置D三颈瓶中通入干燥纯净Cl2,当瓶中充满黄绿色气体时,再打开K1、K3,制备ClNO,D中发生的反应方程式为________。
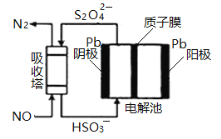
(4)NO可用间接电化学法除去,其原理如下图所示。电解池阴极的电极反应式为________;吸收塔内发生的离子方程式为_______。
(5)亚硝酰氯(ClNO)纯度的测定:将所得亚硝酰氯(ClNO)产品13.10g溶于水,配制成250mL溶液;取出25.00mL,以K2CrO4溶液为指示剂,用0.87mol·L-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为 20.00mL。(已知:Ag2CrO4为砖红色固体),则亚硝酰氯(ClNO)的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 把100 mL 3 mol·L-1的H2SO4跟100 mL H2O混合,硫酸的物质的量浓度为1.5 mol·L-1
B. 把100 g 20%的NaCl溶液跟100 g H2O混合后,NaCl溶液的质量分数是10%
C. 把200 mL 3 mol·L-1的BaCl2溶液跟100 mL 3 mol·L-1的KCl溶液混合后,溶液中的c(Cl-)仍然是3 mol·L-1
D. 把100 mL 20%的NaOH溶液跟100 mL H2O混合后,NaOH溶液的质量分数是10%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com